Las afecciones crónicas del hígado son las causas más comunes de la ascitis e implican la presencia de hipertensión portal.
Diagnóstico:
La principal manifestación de la ascitis es la
distensión abdominal, la mayoría de las veces de aparición insidiosa: el
paciente nota un cambio del tamaño de su cintura y la necesidad de
modificar o cambiar la ropa.
El dolor no es un signo característico, aunque algunas veces existe una molestia dorsal imprecisa.
La disnea aparece cuando la ascitis está a tensión. Muchas veces el
examen físico muestra un paciente ictérico con evidencias de deterioro
muscular.
El abdomen está distendido y se observan venas abdominales
prominentes con circulación colateral de tipo portal, que se irradian
desde el ombligo en dirrección cefálica y/o caudal. La matidez
desplazable de los flancos es el signo más temprano de
ascitis. El hígado y el bazo son de difícil palpación cuando existe
ascitis abundante, pero pueden provocar el signo del témpano.
Se puede encontrar onda ascítica.
El aumento de la tensión abdominal, puede producir la protrusión de
las hernias, la mayoría de las cuales son umbilicales aunque también se
observan las inguinales y a través de anteriores laparotomías.
Las radiografías simples de abdomen pueden mostrar
hepatoesplenomegalia, opacidad difusa del abdomen con eliminación de la
sombra de los psoas y separación de las asas intestinales. La
radiografía de tórax puede revelar derrames pleurales.
La ecografía es de utilidad para el estudio de la ascitis, ya que
puede detectar la presencia de cantidades pequeñas de líquido, aún 100
ml. La presencia de ascitis se confirma con la paracentesis diagnóstica.
En la cirrosis el líquido es un trasudado con una densidad inferior a
1.016 y una concentración de proteínas inferior a 2,5 gm/100 ml. El
recuento celular es inferior a 300/ mm3, en su mayor parte constituido
por células mononucleares.
Diagnóstico diferencial:
La ascitis aparece en otros dos tipos de hipertensión
portal: la obstrucción de las venas suprahepáticas (síndrome de Budd
Chiari) y la trombosis de la vena porta.
En la obstrucción de las venas suprahepáticas el comienzo de la
ascitis suele ser brusco. La ictericia es leve o está ausente y el
hígado está muy agrandado, doloroso, de consistencia aumentada y de
superficie lisa. Es rara en presencia de trombosis portal no complicada
pero puede aparecer luego de tratamientos infructuosos para su
corrección quirúrgica.
La ascitis se desarrolla en algunos casos como complicación de
las anastomosis portosistémicas.
Por lo general, en estos casos se debe a insuficiencia hepatocelular o
a la excesiva administración posoperatoria de soluciones salinas.
La ascitis muestra una particular predilección para aparecer en presencia de flujo portal invertido.
Por último, la ascitis en el posoperatorio puede deberse en algunos casos, a la trombosis de la anastomosis venosa.
Fuera de la hipertensión portal existen otras causas de ascitis:
1. Ascitis relacionadas con neoplasias peritoneales. El líquido
ascítico puede ser muy hemorrágico o contener hematíes; la concentración
de proteínas es mayor que 2,5 gm/ l00 ml.
2. Ascitis relacionada con la tuberculosis. El líquido es turbio. Hay
aumento del número de células, en especial de linfocitos. El diagnóstico
se establece por el cultivo de los bacilos ácidorresistentes o por el
estudio histológico de los granulomas.
3. Ascitis pancreática. Suele encontrarse asociada con seudoquistes de
páncreas. El líquido tiene elevada concentración de proteínas y
amilasas.
4. Ascitis quilosa debida al bloqueo linfático, en general por un
linfoma. Puede constituir también una complicación de un trauma
quirúrgico inferido a la cisterna quilosa. El líquido ascítico es de
aspecto lechoso por su elevado contenido en lípidos, que puede
demostrarse por la coloración con Sudán III
5. Ascitis relacionada con la nefrosis, se acompaña con edemas generalizados y albuminuria.
6. Ascitis relacionada con la pericaditis constrictiva. El diagnóstico
se reafirma por la presencia de calcificaciones pericárdicas,
ingurgitación yugular y pulso paradojal.
Patogenia
Los factores que facilitan el desarrollo de la ascitis
en la cirrosis son una combinación de hipertensión portal, reducción de
la presión coloidosmótica intravascular por la hipoalbuminemia y aumento
de la filtración de linfa a nivel de los linfáticos hepáticos
distendidos.
El cambio principal que se observa en el sistema neurohormonal, es el
aumento de la actividad simpática y el hiperaldosteronismo. El aumento
de la actividad simpática debido a la estimulación de los
barorreceptores, como consecuencia de la reducción del volumen
intravascular.
Aumento de la retención de sodio. El aumento de la aldosterona se debe a la estimulación de la corteza adrenal por angiotensina.
En el paciente con cirrosis, se liberan grandes cantidades de renina
como respuesta del aparato yuxtaglomerular a la redistribución del flujo
sanguíneo y a la reducción de la irrigación de la corteza renal.
Existe además una alteración del clearence de agua, secundaria al aumento de la hormona antidiurética.
Complicaciones de la Ascitis:
Los pacientes con cirrosis y ascitis están expuestos a
desarrollar dos complicaciones importantes: la peritonitis bacteriana y
el síndrome hepatorrenal.
La peritonitis bacteriana y la bacteriemia aparecen en forma
espontánea sin una aparente fuente clara de infección. Los síntomas
principales son fiebre, dolor abdominal y disminución de los ruidos
intestinales. El examen del líquido ascítico revela una elevada
densidad, gran concentración de proteinas, y un recuento elevado de
células. Leucocitos (> 300/ml). El hallazgo de más de 500
polimorfonucleares por ml es evidencia de peritonitis bacteriana aun en
pacientes asintomáticos. Las bacterias que con mayor frecuencia se
cultivan son la Escherichia colí,neumococos y estreptococos
beta-hemolíticos. Las bacterias anaerobias sólo rara vez producen
peritonitis.
El síndrome hepatorrenal se caracteriza por su aparición lenta, con
oliguria y azoemia asociada con el deterioro de la función hepática. La
diuresis diaria puede disminuir hasta llegar a sólo l00 o 150 ml, pero
nunca llega a la anuria total. Son factores precipitantes reconocidos la
depleción aguda del volumen plasmático secundaria a la administración
de diuréticos, la paracentesis, las hemorragias digestivas o la
septicemia. La causa de la insuficiencia renal parece estar vinculada
con la redistribución del flujo renal excluyendo a los glomérulos.
El síndrome hepatorrenal debe ser diferenciado del daño tubular
agudo, que puede ser producido por hipotensión, hipokalemia o exceso de
administración de neomicina. En el daño tubular agudo el sedimento
urinario muestra cilindros celulares y anormalidades en la capacidad de
concentración y retención de sodio.
No existe tratamiento específico para el síndrome hepatorrenal. Se
trata, como otras situaciones de insuficiencia renal, mediante la
restricción de los líquidos, sodio, potasio y proteínas. En algunos
casos, la infusión de dopamina o la colocación de las derivaciones
peritoneovenosas han producido mejorías de la función renal.
Tratamiento médico:
Como consecuencia de la incapacidad que muestra el
paciente cirrótico para excretar el sodio en forma efectiva, la mayor
parte del sodio contenido en la dieta es retenido.
El tratamiento principal de la ascitis se basa en la restricción del sodio.
La natremia baja indica la retención de líquidos por encima del sodio retenido.
Los pacientes cirróticos tratados con reposo en cama y restricción de
agua y sodio suelen desarrollar una diuresis espontánea que coincide
con la mejoría de su función hepática.
El uso de diuréticos, con control de los electrolitos séricos, urea y
creatinina se inicia con Espironolactona, que actúa inhibiendo la
acción de aldosterona, produciendo un aumento de la excreción de sodio y
también reduce la pérdida de potasio. La dosis inicial es de 100 mg /
día, que puede ser incrementada en forma gradual hasta 400 mg/día. La
ginecomastia puede complicar la administración prolongada de
espironolactona.
Para obtener una diuresis más efectiva se combina con
hidroclorotiazida, 50 a 100 mg/día, o fursemida en dosis de 40 mg /día,
pero puede producir una pérdida exagerada de potasio, por lo que se lo
administra a este elemento en tabletas.
Las paracentesis diaria de 4 a 6 litros, junto con la infusión
intravenosa de 40 g de albúmina pobre en sodio, ha sido efectiva para su
control.
Pronóstico y resultados del tratamiento médico:
El pronóstico de los pacientes con afecciones hepáticas
que presentan ascitis es malo; se estima una supervivencia media de 2
años cercana al 40%. Este pronóstico depende, en forma especial, del
estado funcional del hígado.
Es obvio que cuanto más avanzada es la afección hepática, con ictericia y encefalopatía, peor es el pronóstico.
La respuesta satisfactoria a los diuréticos, que determina el control
de la ascitis pero no en forma necesaria su eliminación, se observa en
el 75 % de los pacientes.
Tratamiento quirúrgico:
Cerca del 5% de los pacientes no muestran ninguna
mejoría con el tratamiento médico y otro 20% sólo presentan una
respuesta parcial. Para este grupo de pacientes se han ideado diversos
tratamientos quirúrgicos. Ninguno de ellos tiene en la actualidad
aplicación alguna en el tratamiento de la ascitis.
La única operación que en la actualidad se utiliza para el tratamiento
de la ascitis refractaria al tratamiento, es la derivación
peritoneo-venosa. Las derivaciones porto-sistémicas, no indicadas sólo
para el tratamiento de la ascitis, han determinado
consecuencias sobre la ascitis que merecen especial consideración.
La ascitis es muchas veces un signo de enfermedad hepática avanzada y en
algunos casos el trasplante hepático está indicado para revertir la
insuficiencia hepática y aliviar la ascitis.
Efecto de las derivaciones portosistémicas
La presión sinusoidal aumentada, secundaria al bloqueo
post sinuosidal, es uno de los factores involucrados en la producción de
la ascitis.
Esta hipertensión sinusoidal causa, en forma presumible, aumento de
la linfa hepática en los espacios de Disse y la formación de ascitis. El
hiperaldosteronismo secundario está también relacionado de alguna forma
con ese fenómeno. La mayoría de las derivaciones portosistémicas
reducen la presión sinusoidal y, por ello, tienden a aliviar la ascitis,
aunque algunas son más efectivas que otras en relación con ese efecto.
La anastomosis portocava término-lateral elimina el aporte portal al
flujo hepático y de esta forma reduce la presión intrahepática. Sin
embargo, esos shunts no reducen la hipertensión sinusoidal a niveles
normales. Por otra parte, tampoco mejoran la salida de la sangre
hepática. Por ello, en los pacientes con estancamiento bidireccional, o
con flujo portal invertido espontáneamente, esas anastomosis pueden
condicionar aumento de la presión sinusoidal al eliminar la posibilidad
del flujo retrógrado a través de la vena porta. Por esta razón es
probable que entre el l0 y el 15% de los pacientes desarrollen ascitis
luego de la creación de un shunt portocava término-lateral.
La anastomosis portocava látero-lateral no sólo deriva del hígado la
sangre esplácnica sino que también sirve como tracto de salida para el
flujo retrógrado de la sangre portal desde el hígado hacia la vena cava
de menor presión. Es probable que, por esta razón, la presión sinusoidal
se reduzca hasta lo normal luego de esas derivaciones. Por lo tanto, la
anastomosis portocava látero-lateral ha mostrado ser efectiva para el
tratamiento de la ascitis refractaria al tratamiento, controlando tanto
el hiperaldosteronismo como el exceso de producción de linfa hepática.
Existen diversas técnicas para las derivaciones portosistémicas que en
realidad funcionan como shunts látero-laterales. Entre ellas se incluyen
el shunt esplenorrenal común, el mesocava directo, el mesocava con
injerto en H, el portorrenal y otros, cuyos efectos fisiológicos son
similares a los producidos por las anastomosis látero-laterales y hacen
pensar que pueden ofrecer la misma efectividad.
Debe hacerse notar que los shunts portosistémicos electivos, como el
esplenorrenal, han sido diseñados para preservar el flujo
mesentérico-portal y por lo tanto, mantener una presión sinusoidal
elevada y por ello tienden a producir o agravar la ascitis.
Estas operaciones no deben ser utilizadas sólo para el tratamiento de
la ascitis. Sin embargo, cuando se precisa un shunt para controlar las
várices esofágicas sangrantes, la selección específica del tipo de
derivación que debe practicarse, por lo menos en parte, debe considerar
la presencia o ausencia de ascitis grave o intratable.
Paracentesis:
Esta terapéutica sigue siendo practicada; ya no se
considera apropiado drenar la ascitis en forma completa. En la
actualidad, el paciente se coloca en posición supina. Es importante que
la vejiga esté vacía. Los lugares de preferencia para la inserción del
catéter o el trócar se encuentran en la línea media, a un tercio de la
distancia umbilicopubiana o inmediatamente por fuera del músculo recto
anterior y en cualquiera de los cuadrantes inferiores. Se desinfecta y
aisla la zona seleccionada y luego se efectúa anestesia local con
lidocaina.
Para la paracentesis se pueden utilizar diferentes técnicas pero
quizás la más simple sea la de agregar tres orificios laterales en la
porción terminal de un catéter común. Luego de punzar la cavidad
abdominal con un trócar se introduce el catéter, se extrae el trócar y
luego se aspira con una jeringa de tres vías. El catéter puede ser
fijado a una tubuladura para infusiones intravenosas que se conecta a un
recipiente colector colocado en el suelo, dejando que el líquido
ascítico fluya por efecto de la gravedad.
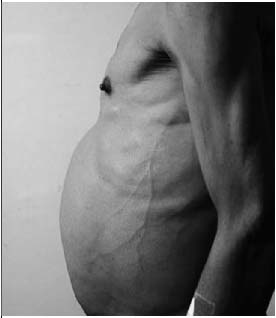 |
| Figura. 1 Vista lateral de paciente con ascitis secundaria a cirrosis hepática |
Derivación peritoneaovenosa
La válvula activada por presión, diseñada por Leveen, se
abre sólo cuando existe un gradiente de 3 a 5 cm de H2O entre la
presión peritoneal y la de la vena cava superior intratorácica. De esta
forma, si la presión venosa sube por la infusión excesiva de líquido
ascítico, la válvula se cierra y evita el retroceso de la sangre hacia
el tubo y su trombosis.
Los drenajes peritoneovenosos pueden insertarse bajo anestesia local,
aunque se prefiere la general, cuando es posible, debido a la
dificultad existente para la creación del túnel subcutáneo bajo los
efectos de la primera.
En el preoperatorio se debe obtener una muestra de líquido ascítico
para su cultivo y recuento celular. La colocación de la derivación
peritoneo-cava está contra-indicada si el cultivo es positivo o si el
recuento revela más de 300 elementos por ml.
Se efectúa una incisión abdominal transversal de 4 a 5 cm por fuera del
músculo recto anterior y por debajo del reborde hepático; se divulsionan
los músculos abdominales hasta alcanzar el peritoneo. Se colocan sobre
el peritoneo jaretas opuestas de tracción, de material absorbible 3-0,
para luego efectuar la apertura peritoneal entre ellas. Se considera
como un hecho bien establecido que el riesgo de la coagulación
intravascular diseminada posoperatoria puede reducirse en forma
significativa si se elimina la mayor parte del líquido ascítico en el
momento de la operación.
Una vez que se ha evacuado el volumen deseado, se extrae la cánula de
aspiración y se introduce en el peritoneo el tubo perforado y el tallo
de la válvula.
Se tracciona de ambas jaretas ajustando los hilos alrededor del tallo
de la válvula y dejando que el tubo perforado se llene con líquido
ascítico, luego de haber eliminado su contenido aéreo, para luego
pinzarlo con una pinza de Kelly con ramas acolchadas con tubos de goma.
El extremo venoso del tubo se arrolla y se fija con una hebra larga de
seda para facilitar su tracción y pasaje a través del túnel subcutáneo.
En la zona supraclavicular homolateral se traza una incisión vertical o
transversal, por detrás del borde posterior del estemocleidomastoideo.
Se lleva este músculo hacia adentro y se reconoce la vena yugular
interna para luego liberarla en una extensión de 3 ó 4 cm y aislarla
entre pinzas vasculares o asas de hilo. Se crea un túnel subcutáneo
mediante un instrumento adecuado y luego se arrastra a su través el
extremo venoso del tubo hasta alcanzar el cuello. Se mide el tubo con
cuidado, de modo que pueda ingresar a la vena yugular y alcanzar sólo
hasta el segundo espacio intercostal. Para evitar la trombosis temprana
del sistema, es imperativo que el tubo venoso sea colocado en este
nivel, es decir a la altura de la unión de la vena cava superior con la
aurícula derecha. Se recorta el exceso del tubo en pico de flauta
descartando el sobrante. La válvula misma queda por fuera del peritoneo y
recubierta por los músculos, aponeurosis, tejido subcutáneo y piel, que
se cierran todos con sutura continua, incluyendo la piel, a fin de
evitar la filtración del líquido ascítico.
BIBLIOGRAFÍA
1. Friedman L, Isselbacher K. Principios de Medicina Interna. Madrid: Ed. Interamericana McGraw-Hill; 1995. p. 93-5.
2. Reis E. Ascites evaluation and treatment Medstudents-Internal Medicine. http://www.medstudents.com.br/ medint/medint3.htm
3. Gary F. Managing Ascites in Palliative Care Nursing Notes. Regional Palliative Care Program in Edmonton Alberta. Nov 2000.
4. Waller A. In: Handbook of Palliative Care in Cancer. 2th ed. Butterworth Heinemann, 2000. p. 231-6.
5. Runyon BA. Care of patients with ascites. N Engl J Med 1994; 330: 337-42.
6. Claud R. Management of ascites in advanced cancer -a flow diagram. Palliative Medicine 1989; 4: 45-7.
7. Sun-San W, Chi Wen L, Yee Chao, et al. Malignancy-related ascites: a
diagnostic pit fall of spontaneous bacterial peritonitis by ascites
fluid polymorphonuclear cell count. J Hepatol 1994; 20: 79-84.
8. Walker LD, Casciato AD. Ch. 30: Abdominal complications. In: Casciato
AD. Manual of Clinical Oncology. 4th ed. Lippincott Williams &
Wilkins ed. 2000. p. 569-78.
9. Runyon A. Editorial: Malignancy-related. Ascites and ascitic fluid.
Humoral test of malignancy. J Clin Gastroenterol 1994; 18: 94-8.
10. Gotlieb WH, Heldman B. Intraperitoneal pressures and clinical
parameters of total paracentesis for palliation of symptomatic ascites
in ovarian cancer. Gynecologic Oncology 1998; 71: 381-5.
11. Kuruvilla A, Busby G, Ramsewak S. Intraoperative placement of a
self-retaining Foley catheter for continuous drainage on malignant
ascites. Eur J Gynaecol Oncol 2002; 23: 68-9.
12. O’Neill MJ, Weissleder R, Gervais DA, Hahn PF, Mueller PR. Tunneled
peritoneal cateter placement under sonographic and fluoroscopic guidance
on the palliative treatment of malignant ascites. Am J Roentgenol 2001;
177: 615-8.
13. Sartori S, Nielsen I, Trevisani L, Tassinari D, et al.
Sonographically guided peritoneal cateter placement in the palliation of
malignant ascites in end-stage malignancies. Am J Roentgenol 2002; 179:
1618-20.
14. Mercadante S, La Rosa S, Nicolosi G, Garofalo SL. Temporary drainage
of symptomatic malignant ascites by a catheter iserted under
computerized tomography. J Pain Symptom Manage 1998; 15: 374-8.
15. McNamara, P. Paracentesis -an effective meted of symptom control in
the palliative care setting?; Palliative Medicine 2000; 14: 62-4.
16. Gotlieb WH, Feldman B, Feldman-Moran O, Zmira N, et al.
Intraperitoneal pressures and clinical parameters of total paracentesis
for palliation symptomatic ascites in ovarian cancer. Gynecol Oncol
1998; 71: 381-5.
17. Iyengar TD, Herzog TJ. Management of symptomatic ascites in
recurrent ovarian cancer patients using an intrabdominal semi-permanent
catheter. Am J Hosp Palliat Care 2002; 19: 35-8.
18. Barnett TD, Rubins J. Placement of a permanent tunneled peritoneal
drainage catheter for palliation of malignant ascites: a simplified
percutaneous ap-proach. J Vasc Interv Radiol 2002; 13: 379-83.
19. Zanon C, Grosso M, Apra F, Clara R, et al. Palliative treatment of
malignant refractory ascites by positioning of Denver peritoneovenosus
shunt. Tumori. 2002; 88: 123-7.
20. Kuruvilla A, Busby G, Ramsewak S. Intraoperative placement of a
self-retaining Foley cateter for continuous drainage of malignant
ascities. European Journal Gynaecology Oncology 2002; 23: 68-72.
21. Richard HM 3rd, Coldwell DM, Boyd-Kranis RL, Murthy R, Van Echo DA.
Pleurx tunneled catheter in the management of malignant asicites.
Journal Vascular Interventional Radiology 2001; 12 (3): 373-89.
22. Lee A, Lau TN, Yeong KY. Indwelling catheters for the management of
malignant ascites. Support Care Cancer 2002; 8 (6): 493-9.