Hemodiálisis en el paciente con insuficiencia renal crónica terminal
La hemodiálisis (HD) ha sido y es la técnica de
depuración extracorpórea renal más utilizada. Ha sufrido cambios
importantes gracias a mejoras en la tecnología dialítica, control del
ultrafiltrado, seguridad, eficacia, biocompatibilidad de la HD y de las
membranas de diálisis, accesos vasculares, calidad del agua y soluciones
de diálisis con bicarbonato; sin embargo, sus principios de difusión y
ultrafiltración no han cambiado (1). La hemodiálisis intermitente (HDI)
se utiliza con 3 sesiones por semana y 4 horas de duración; existen
modalidades diarias como la hemodiálisis diaria corta (HDC) con 6 a 7
sesiones por semana y 2 a 3 horas de duración, la hemodiálisis diaria
nocturna ( HDN ) con 6 sesiones por semana y 8 horas de duración y la
HDI de larga duración con 3 sesiones por semana y 8 horas de duración,
estas se pueden realizar en unidades de hemodiálisis o en casa y las
últimas han sido consideradas de mayor eficacia, más fisiológicas y
menos costosas (1,2,3,4). Actualmente la dosis de HD administrada es
expresada como Kt/V , basado en el modelo cinético de la urea (6). Las
guías K-DOQI consideran una HD adecuada cuando se logra un Kt/V de pool
único de 1.2 a 1.3 o una tasa de reducción de la urea mayor del 65%
debido a que varios estudios han demostrado que al lograr estas metas se
obtiene un descenso en la morbi-mortalidad.(6,7,8)
La HD adecuada representa más que un Kt/V pues aun cuando logremos
esa meta, el paciente puede estar aun inadecuadamente dializado si no
logramos otras metas como peso seco, control de la presión arterial,
anemia, hiperparatiroidismo y un adecuado estado nutricional.(1)
Historia
Thomas Graham, químico Escocés de la primera mitad del
siglo XVIII, estudiando las propiedades de coloides demostró que sólo
los cristaloides difunden a través de una membrana semipermeable. A este
Fenómeno Graham lo denominó DIALISIS palabra griega que significa
separar. En otro experimento usó orina y demostró que los cristaloides
de la orina pasaban a través de una membrana semipermeable hacia el agua
la que al evaporarse dejaba un residuo constituido de cristales de
urea.
John Abel , en Baltimore el 1931, diseñó un método por el cual la
sangre de un animal podía dializarse fuera del cuerpo y de nuevo
regresar a la circulación sin exponerla al aire o a microorganismos,
anticuagulándola con hirudina, un extracto de cabezas de sanguijuela.
Colocó una cánula en una arteria del animal y la conectó a una serie de
sacos de celofán unidos en sus extremos por tubos de goma y contenidos
en un recipiente de vidrio lleno de solución y regresándola a la
circulación a través de otra cánula colocada en un vena del animal…
Von Hess agregó una bomba Pulsátil para impulsar la sangre y
recambios frecuentes de líquido dializante. Algunos intentaron membranas
de origen animal como Necheles quien usó heparina por primera vez. La
primera diálisis con membranas de origen animal para separar de la
circulación productos intermedios cuando estudiaba aminoácidos.
Consideró que la uremia debería mejorar con la diálisis al retirar
productos tóxicos de la sangre. Extrajo sangre animal urémico , la
recirculó dentro de un sistema extracorpóreo de diálisis y luego la
regresó. La primera diálisis en humano duró 15 minutos y no ocurrieron
complicaciones, pocos meses después realizó una nueva diálisis de 35
minutos y no ocurrieron complicaciones, meses después realizó una nueva
diálisis de 35 minutos de duración que provocó reacción febril pero sin
efecto terapéutico.
Willem Kolff médico Holandés, realizó una diálisis con éxito en 1943
con un filtro diseñado por el mismo que consistió de un tubo de celofán
enrollado en un armazón de aluminio colocado dentro de una tina que
contenía líquido dializante, aunque posteriormente la paciente falleció
por falta de accesos vasculares. En 1945 Kolff logró que sobreviviera
una paciente con insuficiencia renal aguda. En 1960, Scribner y Quinton
diseñaron una fístula arteriovenosa interna con puntas de teflón y una
porción externa de silicón que tenía gran duración y que permitió
sobrevivir a pacientes con insuficiencia renal crónica por medio de la
hemodiálisis. Uno de los primeros fue Clyde Shields quien sobrevivió 11
años y murió de un infarto al miocardio.
En 1964, Babb y Scribner diseñaron la máquina que permitió
preparación de concentrados de sales en forma comercial. En 1966 se
generalizó el uso del procedimiento en el tratamiento de la
insuficiencia renal crónica al aparecer la fístula arteriovenosa
diseñada por Brescia y Cimino. Poco después , Lipps introdujo el filtro
de capilares de fibra hueca. A fines de los 70’s. Se llevó a cabo un
estudio multicéntrico que permitió a Sargent Gotch confirmar lo adecuado
de la prescripción de la intensidad de la diálisis por medio de la
cinética de urea. En 1984 alrededor del mundo sobreviven con una
apropiada calidad de vida gracias a la hemodiálisis.
Indicaciones
Para hemodiálisis aguda las indicaciones más comunes son
la presencia del síndrome urémico , hipercalemia , acidosis o
sobrecarga de líquidos. Además, la diálisis habitualmente se inicia
cuando la depuración de creatinina es menor de 7 a 10 ml / min. De hecho
cuando se alcanzan estos niveles de depuración de creatinina en
pacientes con insuficiencia renal crónica debe valorarse el iniciar
hemodiálisis regular aún cuando los niveles de azoados pudieran
mantenerse por algún tiempo con restricción intensa de proteínas. Se
debe prever la necesidad de diálisis para preparar al paciente y crearle
un acceso vascular con tiempo.
Los síntomas comunes presentes en uremia son náuseas, a menudo con
vómito, perdida de apetito, a veces con solo pensar en comer los
pacientes se sienten mal; sensación de fatiga, debilidad, sensacion de
frío; prurito; alteración del estado mental, que van desde pequeños
cambios de personalidad e insomnio hasta la aparición de CONFUSIÓN y en
última instancia, estado de coma. Los signos físicos de uremia incluyen
coloración terrosa de la piel por acumulación del pigmento urocromo
(responsable de dar el color amarillo a la orina) y la presencia de
aliento urémico. Puede haber frote pericardio por pericarditis. En parte
estos síntomas y signos son exacerbados por anemia y desnutrición.
No hay contraindicaciones absolutas para la diálisis pero suele no
proponerse este tipo de tratamiento a pacientes con insuficiencias
orgánicas terminales en otros órganos como pacientes con demencia ,
enfermedad de Alzheimer, síndrome hepatorrenal, cirrosis avanzada con
encefalopatía o carcinomatosis.
Máquinas
Existe básicamente dos tipos de máquinas de diálisis ,
aquellas con un recipiente para contener la solución dializante
previamente preparada y máquinas que cuentan con una mezcladora que
prepara continuamente la solución dializante mezclando concentrado de
sales con agua purificada. En los últimos años se han comercializado
máquinas que además tienen un sistema de control volumétrico del líquido
ultra-filtrado y amplios sistema de alarmas para dar más seguridad
durante el procedimiento.
En general, las máquinas tienen bombas impulsoras de sangre, sistema
de preparación de solución dializante y monitores de seguridad
apropiados que incluyen monitores de la presión dentro de las líneas
arterial y venosa, verificador de la conductividad y temperatura de la
solución dializante, detector de fuga de sangre y monitores de la
presión de infusión de heparina, baumanómetro automático, programas
manuales o computarizados para modificar la composición de la solución
dializante y registro computarizado del procedimiento de diálisis.
Accesos Vasculares
Para poder efectuar el procedimiento estracorporeo de diálisis se requiere tener una puerta de entrada al torrente sanguíneo.
Existen dos tipos de accesos vasculares, temporales y permanentes.
Los temporales principalmente son los catéteres de doble luz instalados
en las grandes venas del cuello. Algunos catéteres están fabricados de
material blando biocompatible como silicón que permite su permanencia
por varios meses sobre todo cuando tienen un anillo de dacrón para
fijarlos a la piel y que funciona como barreta para microrganismos. Los
accesos permanentes están constituidos principalmente por fístulas
arteriovenosas internas en las que una vena del brazo se anastomosa a la
arteria radial o bien se coloca un injerto sintético por ejemplo de
gortex. Las fístulas suelen durar varios años. Las complicaciones más
frecuentes son infecciones y trombosis.
Principios físico – químicos
La hemodiálisis es un proceso por el cual se modifica la
composición de solutos de la sangre cuando es expuesta ante otra
solución dializante de composición parecida a la ideal del plasma, a
través de una membrana semipermeable, que no es otra cosa sino una hoja
perforada por múltiples hoyos o poros por donde atraviesan moléculas de
agua y moléculas de peso molecular pequeño, pero moléculas muy grandes
como las proteínas no pueden pasar. Sin embargo, sólo en forma
aproximada sustituye la función renal normal. Extrae algunas toxinas
urémicas y corrige alteraciones hidroelectrolíticas y ácido base. Para
ello sigue básicamente tres principios.
La DIFUSIÓN en la que el movimiento de moléculas es impulsado por un
gradiente de concentración (con movimiento de mayor a menor
concentración) por lo que su velocidad se incrementa:
1. Si aumenta la diferencia de concentración entre ambos
lados de la membrana.
2. Si aumenta el área de filtración.
3. Si aumenta el coeficiente de transporte de la membrana que
a su vez depende del :
a) Número y tamaño de poros y grosor de la membrana.
b) Tamaño de las moléculas que se van a filtrar.
c) Velocidad del flujo sanguíneo y del flujo del dializante en contracorriente.
La Ultrafiltración es el principio que da lugar a extracción de
líquido a través de la membrana impulsada por una diferencia de
presiones entre ambos lados de la membrana. Se incrementa mientras mayor
sea la presión positiva del lado sanguíneo y/o mayor sea la presión
negativa del lado del dializante.
La Convección es el principio a través del cual se depuran toxinas de
la sangre por medio del arrastre de estas sustancias junto con el
líquido extraído por ultrafiltración.
La dialisancia está en relación inversamente proporcional al peso
molecular. En la siguiente tabla muestra el peso molecular de algunas
sustancias:
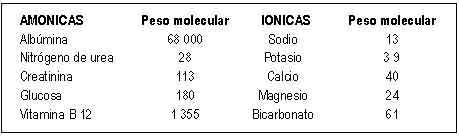 |
Tipos de Hemodiálisis
La Hemodiálisis Convencional utiliza el principio de
difusión para depurar la sangre. Su eficiencia es limitada ya que
utiliza filtros de menor capacidad de depuración de moléculas de peso
intermedio ( más económicos). Puede realizarse en pacientes cuyos
accesos vasculares proporcionen flujos sanguíneos bajos, con máquinas
simples de diálisis y solución con base de acetato. Al mismo tiempo se
puede efectuar ultrafiltracion.
La Hemodiálisis de Alta Eficiencia también se basa en el principio de
difusión y de ultrafiltración sin embargo , requiere máquinas de
control estricto de líquido ultrafiltrado, agua muy purificada, solución
dializante con base de bicarbonato y filtros con gran capacidad de
depuración y ultrafiltración (más costosos), por lo que es más eficiente
y permite una mayor rehabilitación del paciente. Además es mejor
tolerada.
La Hemofiltración es el procedimiento que depura la sangre
básicamente por el principio de convección, para ello se requiere la
ultrafiltración de una gran cantidad de líquido y su reposición con una
cantidad similar de líquido de composición parecida al plasma, las
toxinas son entonces arrastradas con el líquido ultrafiltrado. Por lo
tanto, requiere de filtros con gran capacidad de ultrafiltración ,
máquinas con un control estricto de ultrafiltración y reposición
automática de la cantidad del líquido extraído, asi como un control del
equilibrio electrolito y ácido – base por lo que resulta ser costoso.
Sin embargo, es un procedimiento más fisiológico ( sigue el principio
que la membrana glomerular ) y habitualmente es bien tolerada por los
pacientes aún cuando cursen con inestabilidad hemodinámica.
La Ultrafiltración aislada es el procedimiento a través del cual se
logra la extracción del líquido intravascular por medio de la diferencia
de presión entre ambos lados de la membrana. Es sencillo, barato y
práctico ya que no requiere líquido dializante, pero tiene muy poco
efecto en la depuración de sustancias. Sin embargo, puede ser seguida de
una hemodiálisis convencional sin ultrafiltración lo que permite mejor
tolerancia a este último procedimiento.
La Hemodiafiltración es una combinación entre hemofiltración con
hemodiálisis simultáneamente lo que da lugar a un procedimiento más
efectivo y mejor tolerado en la depuración de toxinas de la sangre,
aunque resulta más oneroso pues requiere filtros y máquinas especiales
para poder realizarlo.
En la Hemoperfusión la sangre circula a través de un filtro de carbón
activado. Este sistema se usa en algunos casos de intoxicación aguda
como la ocasionada por barbitúricos.
Los Procedimientos Contínuos son aquellos en los que permanentemente
pero en forma lenta se efectúa la diálisis , hemofiltaración o
ultrafiltración. Son preferidos para el tratamiento de pacientes
críticamente enfermos. Puede ser arteriovenosos cuando la sangre se
obtiene de una arteria y es impulsada a través del filtro por la misma
presión sanguinea. O puede ser venosa cuando la sangre se obtiene de una
vena ( a través de un cateter yugular o femoral) y es impulsada a
través del filtro por medio de una bomba de sangre. Puede hacerse
Ultrafiltración contínua si la sangre se pasa a través de un filtro con
gran capacidad de ultrafiltración y se mantiene el balance hídrico al
responder con solución de composición parecida a la del plasma , el
exceso del líquido ultrafiltrado. Puede hacerse Hemodialisis contínua si
se utiliza un filtro de hemodiálisis pero con un flujo sanguíneo muy
lento lo que permite hacer un procedimiento suave por lo que es mejor
tolerado por pacientes críticamente inestables. Para este último
procedimiento se utiliza líquido de diálisis peritoneal como solución
dializante, el cual se hace pasar en contra corriente.
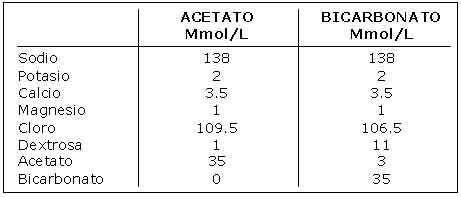 |
| La solución dializante básicamente puede ser de dos tipos dependiendo del buffer utilizado: acetato o bicarbonato. Un ejemplo de composición típica se muestra en la siguiente tabla: |
Prescripción
La prescripción de hemodiálisis se refiere a la dosis
suficiente de este régimen terapéutico que debe administrarse a cada
paciente. La prescripción individualizada debe ser la regla y no la
excepción , por lo tanto amerita evaluar las condiciones del paciente
antes y después de cada sesión , incluyendo determinación periódica de
niveles de toxinas y del grado de función renal residual. La
prescripción comprende los siguientes puntos:
1. Tiempo, durante la década de los 60’s lo habitual era dar sesiones
muy largas hasta de 24 a 36 horas, de duración, generalmente una vez
por semana. Esta prescripción se usó básicamente por lo poco eficiente
del procedimiento y las grandes dificultades técnicas para su
realización. En lo 70’s y 80’s fue costumbre dar sesiones de 12 horas.
Semanales ( 2 sesiones de 3 horas ) y durante la década de los 90’s la
tendencia es dar sesiones de 9 horas semanales ( 3 sesiones de 3 horas.)
Para determinar el tiempo suficiente de diálisis debe tomarse en
cuenta la cantidad de urea por extraerse ( como marcador de toxinas
dializables ) y la capacidad del procedimiento de extraer urea. Para
ello se han usado diferentes abordajes matemáticos de la cinética que
sigue la urea durante el procedimiento de diálisis dado por la
depuración de urea por el filtro y durante el periodo interdialítico
dada por la generación de urea a partir del catabolismo de proteínas. La
más popular es el KT/ V ( volumen de sangre depurado de urea durante el
procedimiento de diálisis dividido entre el volumen de distribución de
la urea en el organismo). Otra aproximación a la cinética de urea es
tomar en cuenta el promedio de concentración del nitrógeno de urea
durante el ciclo de diálisis dividido entre el volumen de promedio de
concentración del nitrógeno de urea durante el ciclo de diálisis (
promedio de la cantidad de urea a la que está expuesto el paciente la
mayor parte del tiempo ) que debe permanecer alrededor de 50 mg / dl +/-
10% y el índice catabólico protéico ( que indirectamente nos indica la
cantidad de proteínas ingeridas por el paciente en el periodo
interdialítico ) que debe ser por lo menos de 1.3 g / kg/ día.
La frecuencia de la diálisis debe ser de 3 sesiones por semana
excepto cuando se cuenta con una función renal residual mayor de 5%
situación que permitirá evaluar la posibilidad de dar solo 2 sesiones
por semana.
2. Filtros: En la actualidad se utilizan 2 filtros para diálisis :
los de placas paralelas y los de fibra hueca. En ambos casos están
formados por una caja o tubo con 4 puertas, dos que comunican con el
compartimento separados por una membrana semipermeable, ya sea dispuesta
en placas o en capilares huecos. El flujo de sangre va en contrasentido
del flujo dializante. Los filtros de la fibra hueca contienen
habitualmente una menor cantidad de volumen en comparación con los
filtros de placas paralelas de una área de superficie. Ambos tipos de
filtros se pueden rehusar pero los de fibra hueca son más apropiados
para ello. La membrana semipermeable puede ser de celulosa o sus
derivados o ser sintética. El tamaño y la permeabilidad a solutos y agua
son variables. Para prescribir se debe tomar en cuenta:
A) Capacidad de la membrana: La capacidad de depuración del filtro está
en relación directa con el coeficiente de permeabilidad de la membrana.
También deberá tomarse en cuenta la permeabilidad específica al agua o
coeficiente de filtración. Las membranas de filtros de alta eficiencia
tienen coeficientes de permeabilidad mayores.
B) Tipos de membrana: Las membranas son de CELULOSA como cuprofán y
el cupramonio, DE SUSTITUTOS DE CELULOSA como el acetato de celulosa, de
CELULOSA SINTETICA como el hemofán, o SINTÉTICAS como la polisulfona y
el poliacrilonitrilo.
C) Biocompatibilidad: La biocompatibilidad de la membrana (capacidad
para despertar la respuesta inmune de coagulación) es variable , en las
membranas derivadas de celulosa radica en los grupos hidróxido libre que
activan complemento. Hemofán, acetato de celulosa y las membranas
sintéticas son más biocompatibles que cuprofán y cupramonio. En general,
las membranas sintéticas son más biocompatibles, permite mayor
depuración de moléculas mayores por convección y tienen mayor capacidad
de ultrafiltración.
3. Solución Dializante: Durante una diálisis habitual el paciente se
expone a 120 litros de agua y cualquier elemento presente en dicho
líquido pasará directamente al torrente sanguíneo del paciente como si
se estuviera administrando por vía intravenosa, por lo que la solución
dializante siempre debe prepararse con agua altamente purificada. Para
ello el agua potable debe pasarse por filtro de arena que retiene las
impurezas orgánicas, filtro de partículas de 10 micras que retiene todo
material por arriba de ese tamaño, filtro de carbón activado que elimina
cloro y cloraminas, filtro de resina de intercambio iónico que elimina
cationes divalentes ( ca + y mg +) y filtro de osmosis inversa que
elimina más 99 % del resto de solutos del agua incluyendo pirógenos.
Es posible hacer modificaciones individuales de la
composición del dializante de acuerdo a las condiciones del paciente,
por ejemplo: se prefiere aumentar la concentración de sodio en paciente
con hipercalemia o aumentar en pacientes que reciben digital o se
encuentran con hipokalemia , se puede disminuir la concentración de
calcio en diabéticos labiles, etc.
La velocidad de solución dializante estándar es de 500 ml/ minuto, se
puede aumentar en diálisis de alta eficiencia o en algunos casos de
hipercalemia grave en que se desea bajar rápidamente el nivel sérico de
potasio. La temperatura del dializante puede también modificarse, se ha
visto que temperaturas bajas, entre 35 y 36 C, cuando son toleradas por
el paciente, disminuyen los episodios de hipotensión.
4. Flujo Sanguíneo: La velocidad de flujo sanguíneo habitual en el
sistema extracopóreo en una diálisis convencional para un paciente
adulto es entre 200 y 350 ml / min. En las diálisis de alta eficiencia
se requieren flujos hasta 500 ml/min. Se considera que el flujo
sanguíneo mínimo efectivo debe ser 4 veces el peso del paciente. A mayor
flujo sanguíneo mayor depuración de toxinas de bajo peso molecular. La
solución dializante a base de acetato limita el uso de flujos altos que
promueven mayor transferencia de acetato a la sangre suscitando
intolerancia del paciente al procedimiento.
5. Extracto de Líquido: se debe llevar al paciente lo más cerca
posible de su peso seco ( peso postdiálisis después de extraer todo el
exceso de líquido). No hay una fórmula simple para calcular el peso
seco, debe hacerse en base a ensayo y error entre un peso seco alto con
riesgo de congestión pulmonar , edema periférico, y HTA y un peso seco
bajo con riesgo de hipotensión y calambres por depleción de volumen casi
siempre en el periodo final de la diálisis. Debe recordarse que el peso
seco puede variar por lo que debe revalorarse periódicamente.
El efecto de la diálisis debe medirse como la respuesta del paciente a
la diálisis y no sólo como capacidad del filtro dializador para extraer
solutos.
Dentro de las razones para considerar a la urea como marcador están:
el soluto orgánico más abundante extraído por la diálisis, pues es
fácilmente dializado por tener un peso molecular muy pequeño, es inerte,
se distribuye en forma uniforme por toda el agua corporal por difusión
aunque cruza algunas membranas por difusión facilitada ( por ejemplo los
glóbulos rojos ) otra propiedad importante de la urea es que proviene
del metabolismo de las proteínas de tal manera que al mismo tiempo
permite intuir la necesidad de diálisis (a través de la velocidad de
generación de urea fundamentalmente en el periodo entre una diálisis y
la siguiente); la efectividad de la diálisis ( a través de la capacidad
de la diálisis para depurar urea ) y finalmente es un indicador
indirecto del estado nutricional pues su generación representa, en
condiciones estables, la cantidad de proteínas ingeridas en la dieta.
La cantidad de diálisis requerida para mantener al paciente en
insuficiencia renal libre de síntomas y con mínimo riesgo de
complicaciones fue controversial hasta que un análisis estadístico de
los resultados del estudio Colaborativo Americano de Diálisis en 1983
demostró que el promedio en concentraciones de Nitrógeno de la Urea
durante un ciclo de diálisis ( periodo intradialítico más periodo
interdialítico) y el índice catabólico protéico correlacionaron mejor
con la evolución del paciente que cualquier otro parámetro estudiado.
El análisis de estos datos demostró que al proporcionar una cantidad
mínima de diálisis de acuerdo al tamaño ( como parámetro del volumen
distribución de la urea dentro del organismo y que corresponde al agua
corporal total ) del paciente aseguraba una buena evolución siempre y
cuando la ingesta proteica fuera mayor de 1.1 g /kg/día. La cantidad de
diálisis se debería estimar como KT/ V tomando en cuenta los siguientes
factores: depuración del filtro ( K ) duración de la sesión de
hemodiálisis ( T ) y el volumen de distribución de urea en el paciente
(V) y sugería mantener el promedio de concentración de nitrógeno de Urea
en 50+ /-mg/dl, el Indice catabólico protéico en 1.2 + / -0.2 g / kg /
dia y el KT/V >1 en un esquema de 3 sesiones por semana cada una
mayor de 3 horas.
El análisis de Gotch y Sargent de la cantidad de diálisis expresada
como KT/ V mostró que cuando el KT/V era mayor de 0.9 la morbilidad fue
de 13 % en cambio la morbilidad fue mucho mayor cuando el KT/V fue menor
de 0.9. a partir de este estudio el KT/V ha sido el determinante más
aceptado de “diálisis adecuada” donde K es la depuración de NU del
filtro , T es la duración de hemodiálisis y V es el volumen del paciente
donde se distribuye la urea ( agua corporal total ). En otras palabras
compara la intensidad de la diálisis ( KT) con el tamaño del paciente ( V
). KT representa el volumen de sangre depurada de área durante una
sesión de HD expresada en mililitros. Pero a final de cuentas es sólo un
índice de la cantidad de diálisis proporcionada. Deshavian y Collins
demostraron que la probabilidad de morbilidad puede disminuir casi a 0
si se proporciona un KT/V igual o mayor de 1.3. EL KT/V es de uso común
pero tiene posibilidad de muchos errores , el principal de ellos es que
puede provocar CONFUSIÓN entre las dosis prescritas y la dosis
proporcionada de diálisis. Se debe calcular en base a la reducción de
urea durante el procedimiento mediante un modelo de cinética de Urea y
no obtenerse de la depuración del filtro estimada por el fabricante para
una velocidad de flujo sanguíneo dado y un volumen de distribución
arbitrario.
Dentro de los errores que hacen que la dosis proporcionada sea diferente
de la prescrita están: menor tiempo de diálisis , recirculacion, pobre
calidad de rehuso de los filtros , bombas de sangre descalibradas ,
coagulacion parcial del filtro durante el procedimiento y faltas a las
sesiones de hemodiálisis.
De por sí, la diálisis es un proceso autolimitante, o sea, la
cantidad de solutos removidos disminuye exponencialmente conforme
aumenta la cantidad de diálisis, por lo que si se duplica la cantidad de
diálisis, (KT/ V ) no necesariamente se duplicará la cantidad de
solutos removidos pues mientras más bajos sean los niveles séricos menor
será la modificación en la concentración de urea.
Por ello, el porcentaje de reducción de Urea ( PRU ) podría ser mejor
indicador de la suficiencia de la hemodiálisis , ya que expresa la
proporción de urea que se logra extraer el procedimiento de diálisis.
La patogénesis del síndrome urémico no está completamente entendido.
Tampoco se ha definido claramente el espectro completo de toxicidad
urémico , algunas de cuyas manifestaciones tardan años en aparecer. Un
punto de vista muy simplista sería pretender aliviar la mayoría de las
manifestaciones urémicas al extraer algunas toxinas. De cualquier forma,
siempre se deberá intentar ofrecer la cantidad óptima de diálisis, de
lo contrario, una cantidad de diálisis insuficiente implica dejar al
paciente con el riesgo de presentar complicaciones y poner en peligro su
vida y por otro lado una mayor cantidad de diálisis tendrá importantes
repercusiones sociales, emocionales y económicas.
Para poder lograr una hemodiálisis óptima también deben de tomarse en
cuenta: uso de eritropoyetina, suplementos de vitaminas hidrosolubles y
hierro , fijadores intestinales de fósforo, análogos de vitamina D,
suplementos de calcio , tratamiento de condiciones asociadas, control de
equilibrio ácido base prevención y control de infecciones, control de
hipertensión arterial, y lípidos y orientación social y para
rehabilitación.
Son factores asociados que afectan la sobrevida : cantidad
insuficiente de diálisis , diálisis cortas, uso de membranas
bioincompatibles , desnutrición calórica, hipoalbuminemia, hipo o
hiperfosfatemía , hipo o hipercalemia, hipo o hipercalcemia, hipo o
hipertermia, osteodiatrofia, hipertensión , hiperlipidemia, infección,
anemia, acumulación de B2 microglobulina , falta de acceso vascular,
enfermedad coronaria o ateroesclerosa, enfermedad vascular periférica,
hipertrofia ventricular izquierda, enfermedad pulmonar crónica,
diabetes, cáncer y edad avanzada.
Charlara ha logrado sobrevida de 43% a 20 años con hemodiálisis
largas, considera , que la diferencia es un control óptimas de presión
arterial a través de la remoción del volumen retenido.
Nutrición
En los primeros años de la hemodiálisis se intentaba
mantener niveles bajos de urea limitando al máximo posible el aporte
protéico. En la actualidad se reconoce al estado nutricional como uno de
los principales factores pronósticos de sobrevida y de morbilidad : los
pacientes mal nutridos tienen mayor riesgo de fallecer y de adquirir
complicaciones que ameriten hospitalización.
Es difícil valorar la cantidad de proteínas que se ingieren en la
dieta por lo que se debe utilizar la cinética de urea. Desde hace varios
años se estableció mediante estudios de balance nitrogenado que la
relación precisa entre generación de urea y catabolismo protéico. Uno de
los mejores predictores de morbilidad en diálisis ha sido el índice
catabólico protéico , que es un indicador indirecto del aporte protéico
de la dieta.
Complicaciones
Las complicaciones más comunes en hemodiálisis son hipotensión hasta
en el 20 % de las sesiones , calambres hasta en el 15 % , cefalea hasta
en el 5% , dolor torácico o lumbar hasta en el 5%, prurito hasta en el
5% y fiebre y escalofrío en menos del 1% de las diálisis.
Hipotensión: Es la complicación mas común. En la literatura se
informa una frecuencia entre el 4 y 30% de las sesiones cursan con algún
episodio de hipotensión sintomática. Sus causas son: a) relacionada con
una rápida disminución del volumen sanguíneo. Refleja la extracción de
una cantidad de líquido del plasma durante el procedimiento de diálisis a
una velocidad mayor que la reposición del volumen plasmático a partir
del líquido intersticial. Es más posible que ocurra si se utilizan
filtros de gran superficie de área, de gran permeabilidad o diálisis
cortas. Cuando se extrae líquido del espacio vascular por medio de la
ultrafiltración, de volumen plasmático tiende a mantenerse constante por
recuperación del líquido extraído a partir del líquido intersticial.
Cuando la velocidad de extracción supera a la velocidad de recuperación
ocasiona depleción de volumen intravascular a través de una disminución
del llenado cardiaco y por lo tanto del gasto cardiaco, lo que se
traduce finalmente en hipotensión. Esto puede ser secundario a:
(1). Ultrafiltracion desproporcionada, que ocurre más frecuente cuando
la máquina de hemodiálisis no cuenta con un accesorio para controlar
automáticamente la ultrafiltración , ya que la velocidad con la que se
extrae líquido del paciente puede fluctuar considerablemente conforme
varia la presión a ambos lados de la membrana del filtro dializador y se
originan contracción aguda del volumen sanguíneo e hipotensión. Si no
se dispone de máquinas poco permeables al agua de tal manera que la
fluctuaciones inevitables de la presión transmembrana solo provoquen
pequeños cambios en la tasa de extracción de líquidos. (2) ganancia de
peso interdialítica exagerada o diálisis cortas. Cuando aumenta la
cantidad de líquido que necesita extraerse durante la sesión o líquido
de diálisis lo que favorece el desarrollo de hipotensión. (3)
Ultrafiltración mas allá del peso seco del paciente. Conforme se
consigue tener al paciente más cerca de su “peso seco” ( peso sin exceso
de volumen ) disminuye la velocidad a la cual se repleta el
compartimento sanguíneo a partir del liquido proveniente de los tejidos
que lo rodean, como por ejemplo cuando el paciente gana poco peso entre
sesiones de diálisis, asociado a calambres, mareo, malestar general,
náusea y vómito y sensación de agotamiento. (4) sodio del dializante
inapropiadamente bajo. Cuando el nivel de sodio dializante es menor que
el del plasma, la sangre que regresa del filtro dializador es hipotónica
con respecto al líquido que rodea los espacios tisulares. Para mantener
el equilibrio osmótico, sale el agua del compartimento sanguíneo,
reduciéndose el volumen sanguíneo. Este efecto sera más pronunciado
durante la parte inicial de la diálisis, cuando el nivel plasmático de
sodio cae más abruptamente.
B. Hipotensión relacionada a falta de vasoconstricción: Durante la
deplección de volumen para mantener la presión arterial es importante la
constricción de los vasos de capacitancia ( venas ) y los vasos de
resistencia (pequeñas Arteriolas). La constricción de los vasos de
capacitancia ayuda a mantener el llenado cardiaco el gasto cardiaco. La
constricción de los vasos de resistencia ayuda a mantener la presión
arterial. Aunque la causa primaria de hipotensión durante diálisis es
reducción de volumen sanguíneo la hipotensión puede acentuarse cuando se
altera la capacidad de vasoconstricción como en las siguientes
circunstancias: 1. Medicamentos antihipertensivos. La mayoría de los
antihipertensivos altera la capacidad de vasoconstricción. Debido a que
los efectos de estos medicamentos pueden estar presentes durante la
sesión de diálisis , se aconseja no ingerir antihipertensivos previo a
la diálisis. 2. Uso venoso como arterial, por lo que el uso del
dializante a temperatura disminuida ( 35- 36 C ) puede reducir la
incidencia de hipotensión durante diálisis. Como efecto adverso , los
pacientes se quejan de frio incómodo. 3. Dializante con base de acetato.
El acetato es un conocido vasodilatador. Cuando se dializa utilizando
solución dializante con base de acetato, los niveles sanguíneos de estos
iones se elevan importantemente algunos pacientes que presentan
frecuentemente hipotensión durante diálisis con acetato (especialmente
mujeres , pacientes de edad y diabéticos), mejoran considerablemente
cuando se cambia a diálisis con bicarbonato. Aunque hay que señalar que
la mayoría de los pacientes, aún muchos críticamente enfermos , toleran
muy bien el acetato.
C. Hipotensión relacionada a factores cardíacos: Algunos pacientes en
diálisis desarrollan hipotensión por disminución del llenado cardíaco
ya que tienen alterados sus mecanismos compensadores. Son ejemplos de
causas de hipotensión por defecto para aumento de la frecuencia
cardíaca: Ingestión de betabloqueadores, neuropatía autonomicaurémica y
edad, y son ejemplos de hipotensión por defecto para aumentar el volumen
latido las siguientes causas: pobre contractilidad miocardio por edad,
hipotensión , aterosclerosis, calcificación miocardiaca, enfermedad
valvular, amiloiodosis , etc.
Son causas menos comunes de hipotensión tamponada pericárdico,
infarto al miocardio, hemorragia oculta, septicemia, arritmia,
anafilaxis, hemólisis y embolia gaseosa.
Cuando ocurre hipotensión la mayoría de los pacientes se quejan de
debilidad, palidez, diaforesis, taquicardia, angustia, mareo, sensación
de calor o náusea aunque puede llegar a la pérdida del estado de
conciencia y convulsiones. Algunos experimentan calambres. Otros
permanecen asintomáticos hasta que la presión cae mucho. Por lo anterior
la presión arterial se debe verificar periódicamente durante toda la
sesión de diálisis.
El tratamiento debe hacerse rápida y eficazmente, incluye posición de
Trendelemburg, suspención de ultrafiltracion, aplicar cateter nasal de
oxigeno, administrar soluciones hipertónicas ( como glucosa al 50 % o
salina hipertónica) o cargas de salina al 0.9% ( 100ml o más si es
necesario). Otras alternativas son manitol, solución coloidal de
polipéptidos de gelatina y albúmina.
Calambres: Su patogénesis es conocida. Son factores predisponentes:
1. Hipotensión
2. Pacientes por debajo de su peso seco.
3. Hipocalcemia.
4. Hipokalemia.
5. Dializante bajo en sodio.
Se presentan también en relación con ultrafiltración intensa aún
cuando no se documenta baja significativa de presión arterial.
Generalmente ocurren en el periodo final de la diálisis y pueden
persistir hasta varias horas después. Para su tratamiento se prefiere
glucosa o salina hipertónicas, suspensión de ultrafiltración, gluconato
de hipertónicas actúan como transportador osmótico de agua hacia la
sangre proveniente del espacio intersticial e intracelular, ayudando a
mantener el volumen sanguíneo. Se ha intentado sulfato de quinina y
oxazepan pero empíricamente. Y finalmente el ejercicio sobre el grupo
muscular afectado también puede ayudar a PREVENIR los episodios de
calambres.
Náusea y vómito: De etiología multifactorial. En pacientes estables
frecuentemente se asocia a hipotensión. Siempre se deberá considerar la
posibilidad de enfermedad ácido péptica y sangrado de tubo digestivo. Se
observa más frecuentemente en pacientes que ingieren alimentos durante
diálisis.
Cefalea: Es un síntoma común generalmente de causa desconocida. Puede
ser manifestación de síndrome de desequilibrio o efecto del acetato. En
pacientes bebedores de café puede ser manifestación de supresión brusca
de cafeína. Responde a acetaminofén , las pirazolonas también quitan
rápido la cefalea aunque pueden causar hipotensión.
Dolor torácico y/o Lumbar
A menudo se asocian generalmente con filtros nuevos o uso de agua no
purificada. La causa más frecuente suele ser “síndrome del primer uso
del filtro” probablemente relacionado con sustancias usadas para
esterilizar el filtro. También puede ocurrir anginas como manifestación
de insuficiencia coronaria.
Prurito: Es queja frecuente. 85 % de los pacientes llegan a presentar alguna vez y en 25% de ellos es de gran intensidad.
El prurito generalmente se inicia con el síndrome
urémico-prediálisis. Generalmente se localiza en tronco y extremidades y
en ocasiones se asocia a hiperpignación en las áreas afectadas. Empeora
en verano y frecuentemente es episódico. La xerosis ( piel reseca)
ciertamente contribuye en algunos casos, y puede resultar de atrofia de
glándulas sebáceas y de la porción secretora y ductal de las
sudoriparas. La piel reseca siempre debe lubricarse aunque generalmente
tal medida es de poca utilidad. En pacientes con Hiperparatiroidismo se
obtienen grandes alivios con paratiroidectomia. Hipervitaminosis A
también es causa de prurito, los antihistamínicos son prescritos con
frecuencia pero con el inconveniente del efecto sedante. En algunos
pacientes funciona la lidocaina pero con riesgo de hipotensión.
Ketotifen, un estabilizador de células sebáceas, ha sido utilizado con
éxito.
Complicaciones menos comunes
El síndrome de desequilibrio es un cuadro de alteraciones
sistemáticas y neurológicas que se presenta durante o poco después de
las primeras diálisis en pacientes muy urémicos. Sus manifestaciones
iniciales comprenden náusea, vómito, intranquilidad, cefalea,
desesperación , angustia y puede llegar a la desorientación, temblor,
convulsiones, obnubilación y coma.
Se piensa que puede deberse a desequilibrio osmolar , electrolítico o
ácido base en las neuronas. Las molestias leves se tratan
sintomáticamente. En casos graves hay que suspender la diálisis y dar
tratamiento hipertónico con glucosa y manitol. Se recomienda evitar
diálisis enérgicas en pacientes muy urémicos.
La primera diálisis no debe reducir la urea más de 30%.
El síndrome del filtro dializador nuevo incluye tos, urticaria,
sensación de calor o hasta choque anafiláctico. Ocurre durante los
primeros minutos de diálisis. Entonces, hay que suspender la diálisis.
Si es necesario dar antihistamínicos, esteroides y epinefrina. En casos
leves se puede recircular la sangre extra-corporalmente durante 5 a 10
minutos. En pacientes con historia de alergia a oxidé de etilo se puede
utilizar filtros esterilizados con radiaciones de gama o pasar el filtro
nuevo por el proceso de relavado antes de ser usado.
La fiebre se presenta cuando el líquido dializante no ha sido bien
preparado y queda hipotónico. También puede provocarse por contaminación
del dializante con formol, cloro, cloraminas, cobre y nitratos o por
bomba de sangre descalibrada. Otra causa de hipertermia grave. La
hemólisis se detecta por la presencia de sangre con aspecto transparente
con aspecto de agua de Jamaica o grosella. Después de pasar por el
filtro dializador el paciente puede experimentar dolor lumbar y disnea.
Si no se detecta rápidamente dará lugar a hipercalemia y paro cardíaco.
La embolia de aire es una catástrofe potencial de cualquier sesión de
diálisis que rápidamente lleva a la muerte. En pacientes sentados el
aire inyectado puede irse a las venas cerebrales provocando cama y
convulsiones. En pacientes acostados el aire pasa a corazón y pulmones
ocasionando tos, disnea y dolor torácico. Si ocurre se debe poner al
paciente inmediatamente acostado de su lado izquierdo con los pies en
alto , dar oxigeno y broncodilatadores.
Hepatitis: Indudablemente es un problema más grave de infección
asociado a hemodiálisis crónica. Afecta a pacientes y personal, su
origen es generalmente transfusiones y contaminación entre pacientes por
el manejo de sangre durante el procedimiento.
Se puede manifestar con todo su cuadro clínico y de laboratorio
característico o permanecer el paciente asintomático y detectarse por
alteraciones en los exámenes de laboratorio; aunque en general, tienen
menores elevaciones de Transaminasas pero más prolongadas y rara vez
desarrollan ictericia. Aunque se desconoce la frecuencia exacta se
acepta que más del 20 % desarrollan hepatopatía crónica.
La hepatitis se asoció con la diálisis desde los primeros años en que
se contó con este procedimiento. Entonces no se habían desarrollado las
pruebas serológicas para la detección de hepatitis y los procedimientos
requerían purgar el sistema extracorporeo con sangre de transfusiones,
además el paciente requería de frecuentes transfusiones para corregir su
anemia. Se consideraba que los pacientes estaban potencialmente
infectados y que el problema se resolvería disminuyendo al mínimo las
transfusiones e introduciendo un sistema extracorporeo que requería
pequeños volúmenes de cebado. En realidad el cumplimiento de estas
suposiciones no abatió la incidencia de hepatitis. La eliminación de la
hepatitis por virus B de las transfusiones puso de manifiesto problema
de la hepatitis C que también evoluciona frecuentemente a la forma
crónica.
La alta frecuencia de hepatitis y de portadores de antígeno de
hepatitis indica una mayor incapacidad del paciente en hemodiálisis para
eliminar el virus y por lo tanto es otra evidencia de inmunidad celular
alterada.
Hay varios tipos de virus. El virus A , de transmisión fecal- oral,
es muy raro en hemodiálisis. El virus B y C de hepatitis. En general, la
incidencia de hepatitis B ha tendido a disminuir desde que se busca de
manera sistemática el virus B de la hepatitis en los donadores de
sangre. Sin embargo, 2 estudios realizados en la última década indican
que todavía es frecuente en nuestro medio. En 1983 en el Instituto
Nacional de la Nutrición Salvador Zubirán se estudiaron 29 pacientes en
hemodiálisis, 7 (24 %) presentaron hepatitis en un periodo de
observación de 6 meses, 5 de ellos con antígeno de superficie de la
hepatitis B (AgsHB) positivo (71 %). Todos habían sido transfundidos. En
Monterrey fueron estudiados 16 pacientes durante 20 meses y se encontró
Ags HB en 10 ( 62 % ).
La forma más conocida de transmisión del virus C es por transfusión
de sangre y sus derivados pero hay varios informes en la literatura
donde se ha demostrado transmisión a partir de la diálisis. Los signos y
síntomas son similares entre los diferentes tipos de hepatitis siendo
difícil establecer un diagnóstico etiológico desde el punto de vista
clínico. A los pacientes con hepatitis crónica activa se les puede
ofrecer interferon Recombinante.
Las medidas profilácticas incluyen búsqueda seriada de antígenos y
anticuerpos de superficie y central del virus B, búsqueda de anticuerpos
contra el virus C , efectuar el procedimiento con guantes de hule , uso
de cubreboca, evitar al máximo el contacto con la sangre, lavado de
manos antes y después del procedimiento, aseo cuidadoso del exterior de
las máquinas con soluciones de hipoclorito de sodio , y del anterior con
formol y control estricto de transfusiones. Asi como la inmunización
activa facilitada por medio de la aplicación de vacuna de virus
Recombinante para hepatitis B, que presenta mejores resultados al
aplicarla por vía ID a dosis de 5 mcg cada semana por 8 dosis.
1. Daeleman RA, D’Haese PC, De Broe M: Dialysis. Seminars in Nephrology 21: 204-212, 2001
2. Buoncristiani U, Fagugli R, Quintiliani G et al. Rationale for daily diálisis. Home Hemodyal Int a: 12.18 1997
3. Buoncristiani U, Cairo G, Giombini L. et al. Dramatic improvement in
clinical-metabolic parameter and quality of life with daily diálisis.
Int J Artif Organs 12 (S4): 133-136, 1989
4. Pierratos A, Ouwendyk M, Francoeur R. Experience with nocturnal hemodialysis. Home Hemodial Int 1: 32-35, 1997
5. Lowrie EG, Laird NM: The National Cooperative Dialysis Study . Kidney Int 23: S1-S122, 1983
6. Gotch FA, Sargent JA, Kreen ML: Whither goest Kt/V ? Kidney Int 58: S13-S18, 2000 (suppl 76 )
7. Hakim RM, Breyer J, Ismail M et al: Effects of dose of dialysis on morbidity and mortality. Am J Kidney Dis 23: 661-669; 1994
8. National Kidney Foundation. NKF-DOQI clinical practice guidelines for
hemodialysis adequacy. Am J Kidney Dis 2001; 37(1 suppl 1 ) S3-S58
Publicaciones relacionadas
- El ultrasonido musculoesquelético y la reumatología
- Evaluación pronóstica del uso de octreótide 2 vrs. 5 días en sangrado gastrointestinal superior de origen variceal
- Ley de Murphy para Médicos
- Acerca de nosotros y nuestros servicios
- Acromegalia
- Adyuvancia extendida en Cáncer de mama
- Aprendiendo, Jorge Luis Borges
- Areas nasales por tomografia axial computarizada:
- Ascitis: Mecanismos de producción. Diagnóstico y Tratamiento Dr. J. Alberto Marin
- Asociación CRECE
- Aspectos filosóficos e históricos en la práctica de la medicina interna Casi todos los médicos tienen sus enfermedades favoritas Dr. Hugo Raúl Castro Salguero. Médico Internista, Oncólogo. HGE – IGSS. Instituto Nacional de Cancerología INCAN. Grupo Médico Ángeles
- Calidad de vida en pacientes con hepatitis crónica por virus c vírgenes a tratamiento
- Canal: grupo medico angeles en youtube
- Características de los pacientes diagnosticados con enfermedad de Hansen en los últimos diez años en el INDERMA, Dr. Peter Greenberg Cordero, Director Médico del INDERMA; Dra. Suzzette de León, Jefa de Unidad de Hansen del INDERMA; Dra. Helga María Sarti, Residente III del INDERMA
- Carcinoma Basocelular Superficial: reporte de un caso
- Carcinoma de células de Merkel
- Caso Interesante
- Casos de Autodiscusión
- Casos de autodiscusión 2
- Cinco casos de enfermos con fiebre de origen desconocido
- Colonoscopia virtual 3d tan sensible como la colonoscopia de fibra
- Consejos útiles para dejar de fumar
- Cuerpo editorial
- Curiosidades de la Ciencia y de la Vida
- Curiosidades de la Ciencia y de la Vida 2