Antecedentes históricos
Los pioneros en el estudio científico (1) de la ictericia datan del
siglo XVIII, con las observaciones de Baumes, el cual describió a 10
recién nacidos con ictericia. Baumes sospechaba que la aparición de la
coloración amarilla de la piel se debía a un atraso en la evacuación de
meconio. Otras descripciones fueron hechas a principios del siglo XIX,
las cuales especulaban sobre este fenómeno sin bases firmes. En 1847,
Hervieux realiza descripciones clínicas y anatomopatológicas en
pacientes ictéricos. Su estudio sistemático del tema lo hace un trabajo
excepcional para su época. Muchas de sus observaciones siguen vigentes
hasta la fecha, como son la naturaleza esencialmente benigna de la
ictericia en la mayoría de los casos, la aparición de la ictericia
después del 2 a 4 día de vida y desaparición entre la 2ª y 4ª semana y
la progresión cefalocaudal de la misma. Describe así mismo, coloración
amarilla del tejido cerebral en 31 de los 44 casos de autopsia de
pacientes que cursaron con ictericia. En algunos casos los cerebros
estaban uniformemente teñidos mientras que en otros algunas regiones
presentaban mayor pigmentación que otras. Sin embargo, toca a Johannes
Orth, asistente de Virchow, hacer en 1875 la descripción clásica de lo
que hoy conocemos como kernícterus. En su escrito detalla una coloración
intensa del tejido cerebral, pero con una acentuación mayor en los
núcleos basales, pared del tercer y cuarto ventrículo, hipocampo y las
regiones centrales del cerebelo.
En su descripción microscópica menciona pigmentación importante de la
capa granular y la falta de coloración en los elementos gliales. En
1904, Christian Schmorl acuña el término kernícterus junto con la
descripción de 280 autopsias en neonatos. Schmorl encontró que 114 de
sus casos de autopsia tenían tinción amarilla del tejido cerebral, de
120 pacientes que habían cursado con ictericia durante su corta vida.
Sin embargo, 6 de estos casos tenían coloración más intensa de los
núcleos basales y médula oblongada, dando mérito a Orth por la
descripción previa de este patrón. La descripción microscópica realizada
por Schmorl es notable. Él sugiere que la coloración amarilla no es
simplemente atribuida a la saturación del tejido con los pigmentos
biliares, sino a la unión de dichos pigmentos a elementos estructurales
específicos en el tejido. El examen microscópico del tejido sostiene
esta hipótesis. Algunas neuronas en los núcleos estaban fuertemente
teñidas, mientras que otras tenían un color amarillo más pálido. Estas
últimas exhibieron cambios que sugerían que estaban a punto de morir. La
tinción amarilla también la notó en axones y dendritas, mientras que el
tejido circundante, que Schmorl pensó que era de origen glial, no lo
presentaba.
En 1947, Louis K. Diamond y cols. (2), describieron la cateterización
de la vena umbilical y la transfusión de reemplazo como tratamiento
para la eritroblastosis fetal.
En 1958, Cremer y colaboradores observaron que la exposición de niños
prematuros a la luz del sol o luz azul fluorescente producía una
disminución de la concentración sérica de la bilirrubina (3).
Clasificación de la ictericia neonatal
La bilirrubina existe en cuatro diferentes formas en el suero (4):
Bilirrubina no conjugada unida en forma reversible a la albúmina sérica
(ésta forma la mayor porción de bilirrubina no conjugada en el suero).
Bilirrubina no conjugada “libre”, no unida a la albúmina (fracción relativamente menor).
Bilirrubina conjugada (principalmente mono y diglucurónidos), fácilmente excretables a través del sistema biliar o renal.
Bilirrubina conjugada, unida en forma covalente a la albúmina sérica (bilirrubina “delta”).
Las primeras dos dan una reacción “indirecta” con reactivos diazo
estándar, mientras que las últimas dos formas dan una reacción
“directa”. La bilirrubina “delta” parece estar virtualmente ausente en
el neonato normal, pero se encuentra en cantidades significativas en
niños más grandes y en aquellos con hiperbilirrubinemia conjugada que
resulta de diversas alteraciones hepáticas.
La mayor fuente de bilirrubina indirecta es la destrucción de los
glóbulos rojos y de las proteínas heme. La eritropoyesis inadecuada
produce una cantidad menor. En el sistema reticuloendotelial, las
proteínas heme sufren la acción de la enzima heme oxigenasa para
convertirlas en biliverdina. Esta a su vez, por la acción de la
biliverdina reductasa, es transformada en bilirrubina indirecta, la cual
pasa al torrente sanguíneo. Un gramo de hemoglobina produce 35 mg de
bilirrubina. Una vez en la sangre, la bilirrubina es transportada
principalmente por la albúmina. A su paso por el hígado, la bilirrubina
indirecta es captada por las ligandinas (proteínas “Y” y “Z”) las cuales
la introducen al hepatocito donde es conjugada con el ácido glucurónico
a mono y diglucuronato de bilirrubina, para luego ser excretada a las
vías biliares y el intestino. Una vez ahí, parte de la bilirrubina es
desconjugada por acción de la enzima glucoronidasa y reabsorbida hacia
el torrente sanguíneo (circulación enterohepática). Otra parte de la
bilirrubina conjugada dentro del intestino sufre la acción de las
bacterias donde es transformada en estercobilinógeno (eliminada en las
heces) y urobilinógeno, el cual se reabsorbe y se elimina por el riñón.
Cada uno de estos pasos pueden estar alterados o incrementados en el
neonato. Los niños nacen con una masa eritrocitaria aumentada, con
glóbulos rojos que tienen una vida media menor que los del adulto.
Además están expuestos a trauma durante el parto, lo que incrementa la
formación de cefalohematomas o equimosis lo que se traduce en incremento
en la producción de bilirrubina. También el neonato puede recibir
medicamentos que compitan con la bilirrubina por su sitio de unión en la
albúmina. Durante la vida fetal, no se necesita el transporte ni
conjugación de la bilirrubina por el hígado, ya que la placenta realiza
estas funciones, por lo que los sistemas enzimáticos neonatales deben de
ser inducidos en los primeros días de vida. La ingesta de alimento
después del nacimiento puede estar limitada en el recién nacido,
principalmente si es alimentado al seno materno, lo cual produce una
motilidad intestinal disminuida, así como la adquisición lenta de flora
intestinal normal que lleva a un aumento de la circulación
enterohepática de bilirrubina.
La hiperbilirrubinemia caracterizada por la retención de bilirrubina no
conjugada o indirecta es por mucho el tipo más común de
hiperbilirrubinemia en el recién nacido. La bilirrubina no conjugada es
el tipo de pigmento encontrado en la “ictericia fisiológica” y en los
estados patológicos en los cuales hay una incrementada producción de
bilirrubina, disminución de la conjugación o disminución de la captación
hepática de bilirrubina. La hiperbilirrubinemia conjugada es menos
común en el neonato y más frecuentemente denota una alteración grave de
la función hepática, particularmente una interferencia con la excreción
de bilirrubina por el hígado hacia la bilis o por obstrucción del flujo
de bilis en el árbol biliar. Aproximadamente 90% de los neonatos tienen
concentraciones de bilirrubina sérica mayores que las del adulto. La
mayoría de los recién nacidos se tornarán ictéricos generalmente después
del segundo día de vida. El reto de la ictericia neonatal es distinguir
lo fisiológicamente normal de lo patológico, y de la situación benigna
hasta la que pone en peligro la vida. En la ictericia no fisiológica
deberá de buscarse una explicación a través de una investigación
adecuada.
El diagnóstico de ictericia fisiológica en neonatos de término y
pretérmino sólo puede ser establecido al excluir causas conocidas de
ictericia sobre la base de una historia clínica y estudios de
laboratorio adecuados. Algunos de los criterios que excluyen la
hiperbilirrubinemia fisiológica es que: 1) aparezca en las primeras 24
horas, 2) que exceda una concentración de bilirrubina total de 14.5
mg/dL en el niño alimentado con leche materna o de 11.5 mg/dL en el que
se alimenta con fórmula, 3) incremento de la bilirrubina directa por
arriba de 2 mg/dL y 4) ictericia clínica que persista por más de 2
semanas. A excepción de los niños alimentados al seno materno, un
incremento de bilirrubina de más de 5 mg/dL/día también requiere
investigación. El egreso temprano del binomio madre hijo antes de las 48
horas del nacimiento ha venido a complicar el panorama, ya que la
principal causa de reingreso neonatal es la hiperbilirrubinemia. (5-7)
 |
Historia clínica
Siempre es importante investigar y registrar en la
historia clínica los datos de interrogatorio y exploración recogidos
para cada paciente. La comunicación con el obstetra será un factor
importante para determinar algunas causas de hiperbilirrubinemia. De
principal importancia será la duración del embarazo, debido a la
asociación de prematurez con la presentación de ictericia y el riesgo de
kernícterus. Al evaluar al neonato con ictericia, es importante
determinar si ha existido alguna enfermedad inexplicable durante el
embarazo que pueda indicar la presencia de infección congénita, aunque
la mayoría de los niños tendrán algún grado de hiperbilirrubinemia
directa. Los neonatos cuyas madres han sufrido preeclampsia o diabetes
mellitus también están predispuestos a presentar ictericia. Está bien
reconocido que un embarazo previo puede resultar en sensibilización a
antígenos sanguíneos con una isoinmunización del feto, pero
frecuentemente se olvida que los abortos espontáneos o inducidos tienen
un potencial similar, sobretodo si no se les ha aplicado inmunoglobulina
anti-Rh. La presencia de fiebre materna, ruptura prolongada de
membranas o evidencia de amnioítis aporta datos para incluir a la
septicemia en el diagnóstico diferencial, aunque la mayoría de los niños
tendrán algún grado de hiperbilirrubinemia directa. El progreso en el
trabajo de parto y el parto mismo deben de conocerse o investigarse,
debido a que el trauma durante estos períodos o la utilización de
fórceps o extracción con ventosas de succión pueden resultar en sangre
extravasada en los tejidos del recién nacido, incrementando la
producción de bilirrubina.
La necesidad de reanimación y la valoración de Apgar nos aportarán
datos para asfixia perinatal, lo que ocasiona hipoxia, acidosis y un
incremento en el riesgo de encefalopatía bilirrubínica. Debido a que los
neonatos con anemia hemolítica congénita pueden estar ictéricos desde
los primeros días de vida, una historia familiar de ictericia, anemia,
enfermedades de la vesícula biliar o esplenectomía será útil en el
diagnóstico. La ocurrencia de ictericia en un hermano anterior puede
indicar la presencia de anemia hemolítica o de otros problemas
familiares, como anormalidades congénitas del hígado o fibrosis
quística.
El tiempo de inicio de la ictericia puede ser útil, ya que cuando
ésta se presenta antes de las 24 horas de vida indica que existe una
tasa incrementada de hemólisis, más frecuentemente asociada a
isoinmunización. Para investigar la posibilidad de que la circulación
enterohepática sea una causa importante del problema, el ingreso
calórico y de líquidos del niño deberán de ser determinados, así como la
presencia de vómito, retraso para evacuar meconio o una falla para
subir de peso después de la pérdida normal inicial de éste. Si la
ictericia se inicia poco después en el período neonatal, será importante
saber si el niño es alimentado con leche materna o con fórmula, ya que
la alimentación con leche materna es la causa principal de ictericia que
persiste después de los primeros días de vida. La exploración física es
un factor importante para sospechar la etiología de la
hiperbilirrubinemia. La temperatura del niño debe de ser tomada como
medición de base ya que la hipotermia o fiebre incrementa la posibilidad
de septicemia en el niño ictérico. El peso y la talla deben de
registrarse ya que un niño pequeño puede indicar que sea prematuro o con
bajo peso para su edad gestacional; ambas situaciones están asociadas
con incremento en la incidencia de ictericia. Por otro lado el neonato
macrosómico puede tener una madre diabética o prediabética, lo que
también predisponen a la hiperbilirrubinemia. La circunferencia cefálica
debe de medirse, ya que la microcefalia es comúnmente vista en
infecciones intrauterinas, las cuales pueden estar asociadas a
ictericia. La presencia de cefalohematoma o equimosis extensas pueden
indicar que la hemorragia es la causa de hiperbilirrubinemia. El
crecimiento del hígado o del bazo puede indicar la presencia de anemia
hemolítica o infección congénita. Una masa abdominal o distensión pueden
indicar la presencia de obstrucción intestinal o hemorragia
suprarrenal, las cuales son causas raras de ictericia persistente.
Finalmente la piel deberá de ser cuidadosamente examinada. La plétora
puede indicar la presencia de policitemia, la palidez es un dato para la
presencia de anemia y las petequias pueden estar presentes en el
neonato con infección congénita, septicemia, o enfermedad hemolítica
severa.
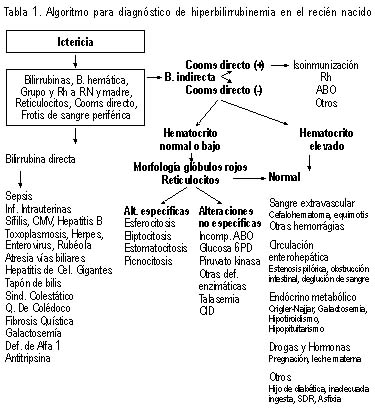
Estudios de laboratorio.- En la presencia de ictericia, el grupo
sanguíneo de la madre debe de ser determinado para indicar la
posibilidad de incompatibilidad a grupo ABO o Rh. La evaluación del
paciente deberá de incluir la determinación de bilirrubinas totales y
fracciones, grupo sanguíneo y Rh, prueba directa de Coombs, fórmula
roja, reticulocitos y frotis de sangre periférica para determinar la
morfología de los glóbulos rojos. La determinación de bilirrubinas nos
permite conocer con exactitud los niveles sanguíneos y tipo de
bilirrubina aumentada. Si la bilirrubina indirecta está aumentada
podemos establecer si el grado de hiperbilirrubinemia puede ser
considerado fisiológico. El grupo sanguíneo y Rh y la prueba de Coombs
nos ayudan a precisar si hay isoinmunización. El hematocrito nos ayuda a
descartar policitemia o anemia. La cuenta de reticulocitos deberá de
realizarse para determinar si existe la presencia de enfermedad
hemolítica (inmunológica o no) y el frotis de sangre periférica para
determinar la morfología de los glóbulos rojos, como la presencia de
esferocitos o fragmentación de los eritrocitos observados en coagulación
intravascular diseminada.
Debido al egreso temprano del binomio madre hijo en algunos
hospitales, se ha incrementado la rehospitalización del neonato,
principalmente debido a hiperbilirrubinemia. Un pequeño grupo de estos
pacientes ha desarrollado kernícterus. La Academia Americana de
pediatría ha sugerido una consulta de seguimiento a los 2 ó 3 días de
vida para los neonatos egresados antes de las 48 horas de nacidos 8.
Algunos estudios (9-12) sugieren que los valores de bilirrubina sérica
tomados en las primeras 24 horas de vida y que sean mayores de 5 a
6mg/dL pueden asociarse a elevaciones importantes de bilirrubina en días
posteriores que requieran mayor estudio o tratamiento. Bhutani y cols.
(11) crearon un nomograma para valorar el riesgo de desarrollar
hiperbilirrubinemia significativa en la primera semana de vida en
neonatos de término o cerca de término, de acuerdo a los valores de
bilirrubina sérica total tomadas en las primeras horas de vida (antes de
egresarse del hospital). Este riesgo también puede ser determinado con
el análisis de bilirrubina tomado por un aparato transcutáneo (13).
 |
Tratamiento
- La meta del tratamiento es de prevenir que la
concentración de bilirrubina indirecta en la sangre alcance niveles en
los cuales puede ocurrir neurotoxicidad, mientras se estudia o trata la
causa subyacente evitando tratamientos que sean más riesgosos. La
ictericia en el neonato es un problema único, por el riesgo de
encefalopatía bilirrubínica a esta edad. En general las dos formas de
tratamiento más comúnmente utilizadas son la fototerapia y la
exanguinotransfusión. Cada una de ellas reduce la concentración sérica
de bilirrubina, la fototerapia por fotoisomerización de la bilirrubina a
un producto que se elimine más fácilmente y la exanguinotransfusión por
remoción directa. En ciertas circunstancias, la administración de un
medicamento tales como el fenobarbital, el cual induce la actividad de
las enzimas hepáticas, puede estar indicado, pero el inicio de acción es
lento y puede ocurrir sedación importante. Uno de los problemas
clínicos que más frecuentemente afecta al neonato es la
hiperbilirrubinemia asociada con la alimentación de leche materna.
Múltiples mecanismos están involucrados, incluyendo la posibilidad de
que algunas madres tengan substancias en su leche que agraven la
tendencia fisiológica de la hiperbilirrubinemia. También importante es
la posibilidad de que el niño no se esté alimentando lo bastante
frecuente o que no consuma el suficiente volumen a la hora de
alimentarse. Estos factores incrementan la circulación enterohepática y
reducen la cantidad de bilirrubina eliminada en las evacuaciones. Una
vez que las otras causas de hiperbilirrubinemia han sido eliminadas,
parece razonable asumir que en el neonato alimentado con leche materna y
por demás sano tenga ictericia como resultado de alimentarse con seno
materno. Ningún tratamiento es requerido a excepción del monitoreo de la
concentración sérica de bilirrubina para asegurar que no alcance
niveles potencialmente tóxicos. El riesgo de encefalopatía en tales
niños es extremadamente bajo. Si la concentración sérica de bilirrubina
se acerca a los 20 mg/dL, puede ser juicioso complementar o interrumpir
la alimentación al seno materno por 24 horas, sustituyendo por una
fórmula apropiada, y volver a medir la concentración de bilirrubina para
documentar una disminución adecuada. Tal procedimiento es a la vez
diagnóstico y terapéutico. Si existe la preocupación de que la cantidad
de leche humana es inadecuada, complementar con una fórmula apropiada
por 24 a 48 horas puede tener un efecto saludable. La alimentación
frecuente para asegurar una ingesta de líquidos y calorías es
importante. La determinación frecuente del peso puede ayudar a
determinar lo adecuado de la ingesta. La fototerapia es innecesaria a
menos que las maniobras anteriores fallen y los niveles de bilirrubina
sérica excedan los 18 a 20 mg/dL. En el raro caso de un neonato que
tenga concentraciones más altas de bilirrubina o que tenga indicios de
letargia, succión débil, o su alimentación inadecuada, se deberá
realizar un tratamiento más agresivo.
Cualquiera que sea la causa de la hiperbilirrubinemia, la finalidad
del manejo será mantener la concentración de bilirrubina sérica por
abajo del nivel que está asociado con encefalopatía. Numerosas guías han
sido publicadas. La Academia Americana de Pediatría a través del
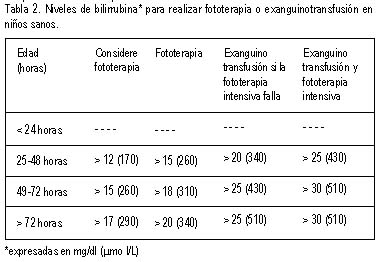
Subcomité de Hiperbilirrubinemia han publicado guías clínicas (tabla 1)
para el manejo de los recién nacidos sanos con hiperbilirrubinemia (14).
Los neonatos pretérmino están en riesgo más elevado de encefalopatía.
De la misma manera, la presencia de acidosis, hipoxia, hipoglicemia o
infección incrementa el riesgo de kernícterus, por lo tanto, un manejo
más agresivo de la hiperbilirrubinemia en neonatos pretérmino está
indicado a una concentración más baja de bilirrubina. Al tomar
decisiones con respecto a la institución del tratamiento, deben tomarse
en cuenta los límites de precisión de las mediciones de laboratorio de
la concentración de bilirrubina sérica.
La fototerapia deberá de iniciarse cuando los niveles séricos de
bilirrubina, tomados en conjunto con la tasa de incremento de la misma y
la edad del paciente, indican la posibilidad de que la concentración de
bilirrubina se incrementará a tal punto en que la encefalopatía puede
ser posible. La observación clínica de la ictericia no es confiable una
vez que la fototerapia ha sido iniciada. La concentración de bilirrubina
sérica debe de ser medida repetidamente hasta que se esté seguro que la
concentración de la misma esté disminuyendo. Después de suspender la
fototerapia, los niveles de bilirrubina deben de ser medidos nuevamente
de seis a doce horas, debido a la posibilidad de rebote de dichos
niveles. En general, el neonato por demás sano puede ser dado de alta
del hospital si el incremento después de la terminación de la
fototerapia no excede los 2 a 3 mg/dL. Existen diferentes tipos de
fototerapia: convencional con luz fluorescente blanca, azul o verde,
halógena, LED (15) (diodos de emisión de luz), fibra óptica, etc. Aunque
teóricamente pueden existir diferencias entre ellas, los estudios
clínicos no han demostrado aumento de la eficacia sobre la fototerapia
convencional aunque sí en menores efectos indeseables. Los efectos
indeseables de la fototerapia son: deshidratación, hipertermia, daño
ocular, disminución del flujo mesentérico y síndrome de niño bronceado.
Esta última se ha reportado con elevaciones de bilirrubina directa en
sangre.
La exanguinotransfusión está indicada cuando los valores de
bilirrubina séricas han alcanzado una concentración a la cual el neonato
está en riesgo de encefalopatía, cuando el recién nacido tiene síntomas
iniciales de encefalopatía o cuando la tasa de incremento es tal que se
pueden alcanzar concentraciones peligrosas de bilirrubina sérica. Todos
los niños con enfermedad hemolítica de recién nacido clínicamente
significativa deberán de ser tratados con fototerapia en un esfuerzo
para evitar la necesidad de exanguinotransfusión. De la misma manera,
todos los neonatos que han tenido una exanguinotransfusión deben de ser
tratados con fototerapia para prevenir, si es posible, la necesidad de
un segundo procedimiento. Las indicaciones para una exanguinotransfusión
de repetición son las mismas que para la primera. Los estudios
reportados por Jackson (16) y Watchko y Claassen (17) sugieren que los
niveles de bilirrubina para realizar exanguinotransfusión en neonatos
prematuros no deberán de ser menores que en los neonatos a término
debido a la baja incidencia de kernícterus en el primer grupo y el
aumento de riesgo de morbimortalidad en éstos. Los efectos indeseables
de la exanguinotransfusión son: hipocalcemia, trombocitopenia
(sangrados), apnea, bradicardia, enterocolitis necrosante, infecciones
transmitidas por la sangre del donador o relacionadas con el catéter
(trombosis, hipertensión renovascular, onfalitis, septicemia, nudo del
catéter).
Un tratamiento nuevo es el uso de la mesoporfirina (18), que es un
inhibidor de la producción de bilirrubina. La dosis recomendada es de 6
mol/kg de peso al nacer, por vía intramuscular. Los efectos clínicos son
que reduce el uso de fototerapia y el tiempo para el alta del paciente
ictérico, así como el número de tomas de muestras en el niño lo que
reduce el dolor y “stress” en el neonato, además de que aminora el costo
por tratamiento. El mecanismo de acción consiste en ser un inhibidor
competitivo de la enzima hem oxigenasa que transforma el grupo hem en
biliverdina. La ventaja del uso de mesoporfirina sobre la fototerapia y
la exanguinotransfusión es que la primera evita la formación de
bilirrubina mientras que los otros dos tratan de disminuirla una vez que
ésta se ha formado y pasado a los tejidos. Los efectos indeseables se
han limitado a la presencia de eritema en algunos pacientes que han
requerido fototerapia.
Seguimiento
Todos los pacientes deberán de tener un seguimiento
durante el primer año de vida con especial énfasis en el desarrollo
neurológico, así como estudios especiales para detectar secuelas
conocidas de la hiperbilirrubinemia como la sordera (19). Esta se puede
llevar a cabo con el estudio de emisiones otoacústicas y confirmada con
potenciales evocados auditivos, para poder realizar una intervención
temprana. La anemia tardía en pacientes isoinmunizados deberá de
buscarse intencionadamente.
Conclusiones
La hiperbilirrubinemia es una de las condiciones más
frecuentes encontradas en el neonato. Las prácticas de egreso temprano
del binomio madre-hijo después del nacimiento han incrementado los
reingresos a las salas de cuidados especiales de recién nacidos
principalmente por este problema. Se hacen esfuerzos para tratar de
detectar a aquellos pacientes en riesgo de desarrollar
hiperbilirrubinemia elevada antes de su egreso. Existen actualmente
nuevas guías para el tratamiento de los pacientes con bilirrubinas
séricas elevadas. La mesoporfirina promete ser un medicamento que nos
ayude a prevenir en forma eficaz la producción de hiperbilirrubinemia y
mejorar el pronóstico para estos pacientes.
Bibliografía 1. Hansen TWR. Pioneers in the scientific study of neonatal jaundice and kernicterus. Pediatrics 2000. 106(2)e15
2. Diamond LK. Erythroblastosis fetalis or hemolytic disease of the newborn. Proc R Soc Med 1947; 40:546-550
3. Maisels MJ. Neonatal Jaundice. In Avery GB. Neonatology.
Pathophysiology and management of the newborn. 3rd Edition, Philadelphia
1987. JB Lippincott Co.
4. Gartner LM, Lee KS. Jaundice and liver disease. In: Fanaroff AA,
Martin RJ. Editors. Neonatal-Perinatal Medicine. Diseases of the fetus
and infant. 4th Edition. St. Louis 1987. C.V. Mosby.
5. Maisels MJ, Kring E. Length of stay, jaundice, and hospital readmission. Pediatrics. 1998;101:995–998.
6. Lee K-S, Perlman M, Ballantyne M. Association between duration of
neonatal hospital stay and readmission rate. J Pediatr.
1995;127:758–766.
7. Braveman P, Egerter S, Pearl M. Early discharge of newborns and
mothers: a critical review of the literature. Pediatrics. 1995;96:716
–726.
8. American Academy of Pediatrics, Committee on Fetus and Newborn.
Hospital stay for healthy term newborns. Pediatrics. 1995;96:788 –790.
9. Bhutani VK, Johnson LH, Sivieri EM. Universal newborn bilirubinsereening. Pediatr Res. 1997;41:191A. Abstract.
10. Seidman DS, Ergaz Z, Revel-Vilk S, et al. The use of bilirubin
measurements on the first day of life for prediction of neonatal
jaundice. In: Program and Abstracts of the Ross Special Conference, Hot
Topics ’96 in Neonatology. Columbus, OH: Professional Services
Department, RossProducts Division, Abbott Laboratories; 1996:284 –294
11. Bhutani VK, Johnson L, Sivieri EM. Predictive ability of a
predischarge hour-specific serum bilirubin for subsequent significant
hyperbilirubinemia in healthy term and near-term newborns. Pediatrics.
1999;103:6–14.
12. Alpay F, Sarici SU, Tosuncuk HD, Serdar MA, Inanç N, Gökçav E. The
value of first-day bilirubin measurement in predicting the development
of significant hyperbilirubinemia in healthy term newborns. Pediatrics
2000;106(2)e16.
13. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH.
Noninvasive measurement of total serum bilirubin in a multiracial
predischarge newborn population to asses the risk of severe
hyperbilirrubinemia. Pediatrics 2000;106(2)e17.
14. American Academy of Pediatrics, Provisional Committee for Quality
Improvement and Subcommittee on Hyperbilirubinemia. Practice parameter:
management of hyperbilirubinemia in the healthy term newborn.
Pediatrics. 1994;94:558 –565.
15. Seidman DS, Moise J, Ergaz Z, Laor A, Vreman HJ, Stevenson DK, Gale
R. A new blue light-emitting phototherapy device: a prospective
randomized controlled study. J Pediatr. 2000 Jun;136(6):771-4.
16. Jackson, JC. Adverse Events Associated With Exchange Transfusion in Healthy and Ill Newborns. Pediatrics. 1997; 99: e7.
17. Watchko, JF, Claassen, D. Kernicterus in premature infants: current
prevalence and relationship to NICHD Phototherapy Study exchange
criteria. Pediatrics. 1994; 93: 996-999.
18. Martinez JC, Garcia HO, Otheguy LE, Drummond GS, Kappas. Control of
severe hyperbilirubinemia in full-term newborns with the inhibitor of
bilirubin production Sn-Mesoporphyrin. Pediatrics 1999;103:1–5.
19. Sheykholeslami k. Otoacoustic emissions and auditory brainstem
responses after neonatal hyperbilirubinemia. Int J Pediatr
Otorhinolaryngol . 2000 Jan 30; 52(1): 65-73.
Ê