El cáncer de mama es una enfermedad muy preocupante en
nuestra sociedad porque afecta a una de cada 10 mujeres durante su
vida. Unos de los retos que tiene la sociedad médica en general es
lograr un diagnóstico temprano puesto que cuando sucede tiene una
sobrevida general del 95%. En el mundo desgraciadamente la mortalidad
sigue siendo muy alta y solo para conocer algunos datos estadísticos se
sabe que en el continente Europeo se diagnostican más de 500,000 mujeres
con cáncer de mama. Sin embargo, aproximadamente 170,000 de estas
mujeres mostraron sobre-expresión/amplificación de HER2, que es un
marcador en el tumor de implicación pronóstica para el paciente y
también la idea para el médico de que debe ser más cuidadoso con quienes
portan este marcador. Adicionalmente estas pacientes tienen la opción
de una novedosa terapia conocida técnicamente con el nombre de
trastuzumab y comercialmente con el nombre de Herceptin®.
¿Qué es HER2?
HER2 es una proteína producida por un gen específico con
potencial de desarrollar cáncer y que se denomina HER2/neu. HER2
proviene del Inglés “Human Epithelial growth factor Receptor-type 2”.
Otra denominación es c-erb B2. Se ha encontrado que a veces el gen HER2
se amplifica, lo que resulta en múltiples copias que lleva a la
sobre-expresión o producción excesiva de la proteína HER2. Esto provoca
que las células se dividan, multipliquen y crezcan en exceso y a un
ritmo mayor que las células normales. Esta reproducción excesiva da
origen al cáncer y a su progresión.
Bajo condiciones normales la proteína HER2 se encuentra prácticamente
escondida en la superficie de la membrana celular, trasmitiendo señales
directamente al núcleo celular y el cual es estimulado para la
reproducción celular en una manera normal. Los factores que estimulan la
replicación celular son factores de crecimiento que se van a ligar al
HER2.
En condiciones de neoplasia la proteína HER2 se ubica en la
superficie de la célula maligna y es el receptor de un factor de
crecimiento que circula en la sangre y que influye positivamente sobre
el crecimiento y diferenciación de la célula maligna, provocando que
ésta se reproduzca en una manera acelerada y con mayor facilidad que
otras células. Bajo condiciones normales hay dos copias de gen HER2 en
cada célula epitelial que es capaz de ordenar la síntesis de la
proteína HER2 en la superficie celular.
El gen anormal que se encarga de la codificación de HER2 es un proto
oncogen y que se encuentra en el núcleo de la célula maligna, fue
descubierto por dos grupos de científicos, por eso es que tiene dos
denominaciones aceptadas: HER2/neu y c-erb B2, que en esencia son lo
mismo.
La situación de sobre-expresión es muy importante que se presente
para que la célula maligna llegue a reproducirse, muchas células
benignas marcan en algún grado en su superficie el HER2 puesto que es un
receptor de un factor de crecimiento epitelial humano que no es
específico.
Desde el punto de vista biológico, el receptor HER2 es miembro de una
familia de receptores de factores estimuladores, o sea, son los ligados
donde llega el factor estimulador, y provoca un crecimiento o
replicación de la células que lo contienen. Los otros receptores se
denominan HER1, HER3 y HER4.
En cantidades normales el HER2 de las células juega un papel importante
en el crecimiento y desarrollo de las células epiteliales y es solo la
sobre-expresión en si una manifestación de anomalía que provoca una
replicación celular acelerada o exagerada.
En la jerga popular médica se expresa que en las pacientes Her-2
positivas, el tumor tiene un comportamiento más agresivo, puesto que
esas células malignas presentan los siguientes comportamientos:
- Incremento en la proliferación del tumor
- Incremento en la sobrevida celular
- Incremento en la invasión
- Incremento en la capacidad de dar metástasis
- Incremento en la capacidad angiogénica
- Pobre respuesta a la manipulación hormonal con estrógenos
Cuando el gen que provee los códigos para la síntesis de
la proteína HER2 en la superficie de la célula logra ampliar su
presencia se habla de sobre-expresión o sobre producción del HER2. La
cantidad excesiva de HER2 lleva a una reproducción descontrolada o de
crecimiento celular maligno lo que da origen al cáncer. El oncogen Her-2
acelera el proceso de crecimiento celular y, por tanto, del tumor. Esto
hace que su sobre-expresión en la pared celular, especialmente en
tumores metastásicos, sea un factor pronóstico muy importante en
relación al tiempo de supervivencia, ya que las pacientes que presentan
este marcador tumoral van a recaer antes que las demás.
Ese gen y la sobre-expresión de HER2 ha sido encontrada en muchos
tipos de cáncer, pero principalmente aparece en cáncer de mama, cáncer
gástrico, cáncer de ovario y algunos tipos de cáncer del tracto
genito-urinario como es el cáncer de vejiga.
En cáncer de mama aproximadamente entre 15 – 30% de los tumores
sobre-expresan fuertemente el HER2, o tienen un gen HER2 responsable de
la amplificación.
La sobre-expresión/amplificación HER2 está relacionada a un mal
pronóstico general y con un comportamiento de mayor agresividad en
contra de quien lo porte, en el caso del cáncer de mama se relaciona con
una mayor posibilidad de recaída que las mujeres que no sobre-expresan
esta proteína en sus células cancerosas, y esto independiente del
estadío clínico de la enfermedad.
Hay un grupo de población que presenta una mayor posibilidad de sobre-expresar la proteína HER2:
- Aquellas mujeres con tumores que evolucionan más rápidamente
- Pacientes que tienen afectación visceral con metástasis en hígado o pulmón.
- Pacientes más jóvenes
- Aquellas que tienen una expresión negativa de receptores de
estrógenos, otro de los marcadores utilizados habitualmente en el
pronóstico del cáncer de mama.
 |
¿Cómo hacer para lograr la mejor detección?
La biopsia de mama entonces es el tejido en donde
debemos buscar este marcador. Una vez removido el tejido es necesario
conservarlo en formalina buferizada para que el gen o la proteína se
puedan identificar bien. Es menester del cirujano indicarle al médico
patólogo que le practique el estudio por HER2, puesto que si no se
solicita no va a ser evaluado de rutina. Si el bloque de tejido es bien
conservado en parafina después de haber estado en la solución de
formalina buferizada, entonces se puede detectar posteriormente hasta
por años. También se puede estudiar la sobre-expresión proteíca en
ganglios linfáticos, y tejido de metástasis, pero no es lo ideal, aunque
si se mantiene una buena correlación de hallazgos positivos.
Existen varias opciones para evaluar el HER2 y la prueba
estandarizada se conoce con el nombre de Herceptest® de la compañía Dako
y los genes se pueden identificar con una prueba más complicada llamada
FISH (del inglés Fluorescence in situ Hybridisation) también de esta
misma compañía. La inmumohistoquímica es la técnica del Herceptest® y
consiste en el desarrollo de un anticuerpo monoclonal que se adhiere a
la superficie de la célula de la biopsia y en un extremo tiene un
colorante de tonos cafés, de tal manera que se expresa en cruces por la
intensidad con que el anticuerpo logra marcar el tumor; y se ha
desarrollado a la siguiente escala:
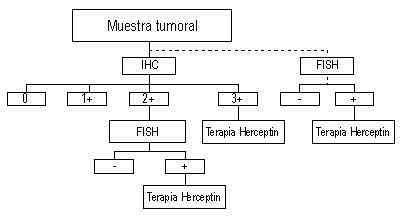 |
La sobre-expresión catalogada como 2+, debe de ser confirmada con la prueba FISH
Lo importante, en todo caso, es que estas pacientes pueden
beneficiarse del tratamiento con trastuzumab, el primer tratamiento
dirigido contra un receptor de oncogenes, capaz de identificar las
células que sobre-expresan el Her-2 y actuar contra ellas, preservando
en todo momento a las células sanas, y no como sucede con la
quimioterapia convencional, que ataca indiscriminadamente a todas las
células del organismo, ya sean tumorales o sanas.
La supervivencia media de las pacientes con cáncer de mama en fase
avanzada (metastásico) se incrementa en un 25%, gracias a la
incorporación al tratamiento de ese anticuerpo monoclonal llamado
trastuzumab (Herceptin®).
El tratamiento está indicado solo para las pacientes 3+, y las pacientes
2+ en que la prueba de FISH sea positiva, también en algunos casos
donde el comportamiento clínico es agresivo y el médico sospecha que el
Herceptest®, por alguna razón no le complace y se realiza el FISH, todas
las pacientes que sean positivas son sujetas a ser tratadas. En
resumen, se puede recomendar seguir el siguiente flujograma:
¿Cuáles pueden ser los hallazgos más importantes para la comunidad médica, en cuanto a terapia combinada?
Los doctores Larry Norton, director del departamento de
Oncología Médica del Centro de Mama en Memorial Sloan-Kettering Cancer
Center de Nueva York y considerado como una de las máximas autoridades
científicas en materia de cáncer, y Dennis Slamon, de la Universidad de
California de Los Ángeles- demuestra que el 50% de las pacientes con
cáncer de mama metastásico que presentan la sobre-expresión de HER2
responde positivamente al tratamiento con trastuzumab en combinación con
quimioterapia.
También en otros estudios previos se encontró que la monoterapia también
tenía un buen índice de eficacia, y ha quedado como una opción más en
el arsenal terapéutico en la lucha contra el cáncer de mama.
Hoy día se considera que la adición del anticuerpo monoclonal
trastuzumab a la quimioterapia eleva la supervivencia de pacientes con
cáncer de mama metastásico, como resultado de los estudios del Dr.
Norton y colaboradores. Durante el desarrollo de este estudio -que
incluía 469 mujeres con cáncer de mama metastásico que no habían sido
tratadas de su enfermedad metastásica con quimioterapia-, se realizaron
distintas opciones, entre las que destaca la combinación del anticuerpo
monoclonal con la quimioterapia convencional (paclitaxel o doxorubicina
más ciclofosfamida). El tiempo medio de progresión de la enfermedad
aumentó notablemente -entre 4 y 7 meses-. Los efectos secundarios se
redujeron a fiebre y escalofríos, especialmente tras la primera dosis.
Los beneficios de añadir trastuzumab a la quimioterapia convencional,
se observaron en el 50% de las pacientes que recibieron dicho
tratamiento. De ello deriva la importancia de tener en cuenta esta
opción terapéutica en el futuro del tratamiento del cáncer de mama,
cuando exista una sobre-expresión del oncogen HER-2.
Los datos que ya fueron publicados en el 2001 (NEJM) fueron
recolectados de un grupo de 499 pacientes que se distribuyeron en forma
aleatorizada en dos grupos, uno que solo recibía quimioterapia y otro
trastuzumab + quimioterapia. El agregar trastuzumab a la quimioterapia
incrementó la sobrevida libre de enfermedad en forma significativa
cuando se comparó a la quimioterapia sola (7.4 versus 4.6 meses),
también incrementó la duración de respuesta (9.1 versus 6.1 meses) e
incrementó la sobrevida global (25.1 vs. 20.3 meses).
La trastuzumab le agregó muy poca toxicidad a la
quimioterapia propiamente y su perfil de toxicidad no incluye vómitos,
ni pérdida de cabello, ni alteración de los sistemas relacionados a la
productividad de la médula ósea (neutropenia, anemia, o trombocitopenia)
El evento adverso más común de carácter leve a moderado es la fiebre
acompañado de escalofríos. Estos síntomas pueden aparecer con la primera
infusión y son tratados en forma profiláctica con acetaminofén y
antihistamínicos. Un evento raro que debe conocer el médico tratante es
la cardiotoxicidad que se presenta con mayor frecuencia en pacientes que
fueron tratadas con doxorubicina, por lo que ya no se recomienda el uso
concomitante.
Lo más reciente en la terapia de las pacientes HER2-positivas ocurrió
en junio 2004 en que las autoridades Europeas aprobaron la terapia
combinada, como primera línea de aborde, en pacientes con cáncer de mama
metastático que sobre-expresan el HER2.
La combinación de Trastuzumab (Herceptin) y docetaxel (Taxotere)
mejora la sobrevida media en forma significativa en más de un tercio
(31 meses con Herceptin más Taxotere vs. 22 meses de Taxotere solo). El
estudio demostró que 61% de las pacientes tratadas con la combinación
respondieron al tratamiento, comparado con 34% de las pacientes que
recibieron el Taxotere solo.
El resultado en la práctica, implica que esa combinación es vital
para cualquier intención de prolongarle la vida a pacientes con Cáncer
de Mama Metastático que sobre-expresen el HER2 y resalta la importancia
de hacer el esfuerzo de detectar este marcador en toda mujer, para poder
abrir estas opciones. Otro aspecto de esta publicación es que se
demostró que el uso temprano logra los mejores resultados, que si lo
comparamos con el uso tardío del Trastuzumab, de tal manera que hace un
gran sentido tratar adecuadamente tumores tan agresivos que responden en
cuanto a disminución de su masa tumoral y además prolongan la vida de
quienes lo usan, con un valor estadísticamente significativo.
¿Qué hay para el futuro?
Es muy probable que en el futuro se diseñen fármacos
específicos frente a tumores caracterizados por un oncogen u otros
blancos (o dianas) moleculares. Se trata, en definitiva de escoger
blancos moleculares únicos para cada tipo de tumor. Primero
identificaremos las posibles blancos moleculares que están alterados
para poder atacarlos de manera selectiva, como es el caso de la
sobre-expresión del HER-2 o de otros oncogenes. Sólo señalar que, en el
caso de BCRA1 o BRCA2, el concepto terapéutico es distinto, ya que se
trata de genes supresores que actúan bloqueando el crecimiento celular
incontrolado y que, por tanto, en lugar de atacar esas proteínas se
deberá, por el contrario, restablecer su función de vigilantes del
descontrol celular.
 |
¿Qué nos falta como comunidad científica?
El lograr que las mujeres sepan de la existencia de
diferentes marcadores en el cáncer de mama, para que sepan que la
escogencia de diferentes opciones de tratamiento, puede depender de este
criterio.
El desconocimiento por parte de las pacientes es importante y se ha
hecho patente en encuestas realizadas en Europa. El resumen de la
encuesta realizada en el 2000, arroja los siguiente datos:
Referencias sugeridas1. Carter P, Presta L,
Gorman CM, Ridgway JB, et al. Humanization of an anti-p185HER2 antibody
for human cancer therapy. Proc Natl Acad Sci USA 1992;89:4285–4289
2. Cancer facts and figures 2003 (American Cancer Society)
3. Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy
plus a monoclonal antibody against HER2 for metastatic breast cancer
that overexpresses HER2. N Engl J Med 2001;344:783–92
4. Cobleigh MA, Vogel CL, Tripathy D, et al. Multinational study of
the efficacy and safety of humanized anti-HER2 monoclonal antibody in
women who have HER2-overexpressing metastatic breast cancer that has
progressed after chemotherapy for metastatic disease. J Clin Oncol
1999;17:2639–2648
5. Vogel C, Melody A, Cobleigh M, et al. Efficacy and safety of
trastuzumab as a single agent in first-line treatment of
HER2-overexpressing metastatic breast cancer. J Clin Oncol
2002;20:719–726
6. Osoba D, Slamon DJ, Burchmore M, et al. Effects on quality of life
of combined trastuzumab and chemotherapy in women with metastatic
breast cancer. J Clin Oncol 2002;20:3106–3113
7. Di Leo A, Dowsett M, Horten B, et al. Current status of HER2 testing. Oncol 2002;63 (suppl.1):33–39
8. Allred DC, Swanson PE: Testing for erbB-2 by immunohistochemistry in breast cancer. Am J Clin Pathol 2000;113:171–427
9. Pauletti G, Godolphin W, Press MF, et al. Detection and
quantification of HER-2/neu gene amplification in human breast cancer
and archival material using fluorescence in situ hybridisation. Oncogene
1996;13:63–72
10. Leyland-Jones B. Maximising response to Herceptin therapy through
optimal use and selection. Anticancer drugs 2001;12(suppl. 4):S11–7
11. Cook-Bruns D. Retrospective analysis of the safety of Herceptin
immunotherapy in metastatic breast cancer. Oncology 2001;61(suppl.
2):58–66.
12. Drebin JA, Link VC, Greene MI. Monoclonal antibodies specific
for the neu oncogene product directly mediate anti-tumour effects in
vivo. Oncogene 1989; 2: 387-94.
13. Hynes NE. Amplification and overexpression of the erbB-2 gene in
human tumours: its involvement in tumour development, significance as a
prognostic factor, and potential as a target for cancer therapy. Sem
Cancer Biol 1993; 4: 19-26.
14. Hynes NE, Stern DF. The biology of erbB-2/neu/HER-2 and its role in cancer. BiochimBbiophys Acta 1994; 1198: 165-84.
15. Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, et
al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian
cancer. Science 1989; 244: 707-12.
16. Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL.
Human breast cancer: Correlation of relapse and survival with
amplification of the HER-2/neu oncogene. Science 1987; 235:177-82.
17. Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, et
al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian
cancer. Science 1989; 244:707-12.
18. Colomer R, Montere S, Lluch A, et al. Circulating HER-2/neu
predicts resistance to Taxol/Adriamycin in metastatic breast carcinoma:
Preliminary results of a multicentric prospective study. Proc Am Soc
Clin Oncol 1997; 16:140a.
19. Hynes NE. Amplification and overexpression of the erbB-2 gene in
human tumours: its involvement in tumour development, significance as a
prognostic factor, and potential as a target for cancer therapy. Sem
Cancer Biol 1993; 4:19-26.
20. Hynes NE, Stern DF. The biology of erbB-2/neu/HER-2 and its role in cancer. Biochim Biophys Acta 1994; 1198:165-84.
21. Di Fiore PP, Pierce JH, Kraus MH, Segatto O, King CR, Aaronson
SA. ErbB-2 is a potent oncogene when overexpressed in NIH-3T3 cells.
Science 1987; 237:178-82.
22. Hudziak RM. Schlessinger J, Ullrich A. Increased expression of
the putative growth factor receptor p185HER2 causes transformation and
tumourigenesis of NIH-3T3 cells. Proc Natl Acad Sci USA 1987;
84:7159-63.
23. Drebin JA, Link VC, Greene MI. Monoclonal antibodies specific
for the neu oncogene product directly mediate anti-tumour effects in
vivo. Oncogene 1988; 2: 387-94.
24. Drebin JA, Link VC, Greene MI. Monoclonal antibodies reactive
with distinct domains of neu oncogene-encoded p185 molecule exert
synergistic anti-tumour effects in vivo. Oncogene 1988;2:273-7.
25. Drebin JA, Link VC, Greene MI. Monoclonal antibodies specific
for the neu oncogene product directly mediate anti-tumour effects in
vivo. Oncogene 1989; 2: 387-94.
26. Carter P, Presta L, Gorman CM, Ridgway JB, Henner D, Wong WL, et
al. Humanization of an anti-p185HER2 antibody for human cancer
treatment. Proc Natl Acad Sci USA 1992; 89: 4285-9.
27. Baselga J, Norton L, Coplan K, Shalaby R, Mendelsohn J.
Antitumour activity of paclitaxel in combination with anti-growth factor
receptor monoclonal antibodies in breast cancer xenografts [abstract].
Proc Am Assoc Cancer Res 1994; 35: 380.
28. Baselga J, Tripathy D, Mendelsohn J, Baughman S, Benz CC, Dantis
L, et al. Phase II study of weekly intravenous recombinant humanised
anti 185HER2 monoclonal antibody in patients with HER2/neu
overexpressing metastatic breast cancer. J Clin Oncol 1996; 14: 737-44.
29. Shan K, Lincoff M, Young JB. Anthracycline-induced cardiotoxicity. Ann Intern Med 1996; 125: 47-58.
30. Norton L, Slamon D, Leyland-Jones B, et al. Overall Survival
Advantage to Simultaneous Chemotherapy Plus the Humanized Anti-HER2
Monoclonal Antibody Herceptin in HER2 Overexpressing Metastatic Breast
Cancer. Presentation at American Society of Clinical Oncology 1999
annual meeting.
31. Slamon D, Leyland-Jones B, Shak S. Herceptin improves time to
progression following chemotherapy in women with metastatic breast
cancer. Presentation at European Congress of Clinical Oncology 1999
annual meeting.
32. Cobleigh M. Herceptin is active as a single agent in women with
metastatic breast cancer overexpressing HER2. Presentation at European
Congress of Clinical Oncology 1999 annual meeting.