Dr. Hiram Humberto Castillo Villatoro. Secretario suplente de la
Asociación Internacional de Microcolpohisteroscopia. Guatemala, Centro
America.
MICROCOLPOHISTEROSCOPIA
• Técnica de gran valor en el estudio de la Patología Cervical, tuvo
sus inicios en el colpomicroscopio desarrollado por Antoine y Grunberger
en 1949 en Austria y modificada para simplificarla y mejorarla por el
Dr. J. Hamou en Francia desde 1980.
MICROCOLPOHISTEROSCOPIO
• Endoscopio de 4 mm de diámetro, 25 cm. de largo, con un ángulo de
90º y una visión foro-oblicua de 30º, que permite tanto la observación
panorámica como de contacto a diferentes aumentos, con la vaina de
estudio tiene un diámetro de 5.2 mm y con la de biopsia llega a 7 mm.
Consta de dos oculares y cuatro aumentos:
1) Directo en el mismo eje de la óptica con aumentos para visión panorámica de 1 y 20; y de contacto a 60 aumentos.
2) El otro ocular es lateral. Visión celular in vivo a 150 aumentos, (fig. 1).
 |
(fig. 1) Microcolpohisteroscopio, con sus vainas.
Equipo complementario
• Fuente de luz de Zenón (luz fría) que puede oscilar entre 150 a 300 Wtz.
• Histeroinsuflador de CO2 (ml./minuto)
• Endocámara.
• Monitor color.
• Impresora fotográfica a color.
• Zoom, opcional.
 |
(fig. 2 ) (fig. 3).
(fig. 2) Monitor, fuente de luz de Xenón, impresora y video-cámara. (fig. 3). Histeroinsuflador con cilindro de C02.
Colorantes vitales
1. Solución de lugol al 2%. Visualiza células provistas de glucógeno.
2. Azul de Waterman. Solución acidofila con PH5, colorea las células
pavimentosas y las primeras papilas cilíndricas expuestas al PH vaginal.
3. Azul de toluidina al 1%. Tiñe las células escamosas y se utiliza
cuando previamente se aplicó ácido acético, ya que ésta dificulta la
tinción, la toluidina es la que mejor se fija a las células.
4. Azul de metileno al 1%. Colorea el epitelio cilíndrico (endocérvix).
 |
(fig. 4) Solución fisiológica, lugol y Azul de Waterman.
Técnica de examen
• Limpieza del cérvix con algodón y suero fisiológico, para quitar el exceso de moco y los detritos celulares.
• Previa aplicación de los colorantes anteriormente descritos y
utilización del Histeroinsuflador a una presión de 15 a 20 ml./min.,
para la dilatación del canal endocervical que también nos sirve para
limpieza del campo para detritos y moco, se realiza el estudio con la
punta distal biselada del microcolpohisteroscopio de todo el conducto
endocervical desde el orificio interno, llegando a la zona de
transformación iniciamos en el labio posterior siguiendo las agujas del
reloj a partir de las 3 horarias por cuadrantes de esta manera si hay
sangrado no nos dificulta la visualización y orientación, identificando
las zonas yodo-negativas y las de mayor concentración de Azul de
Waterman o toluidina.
• Aumento de 1: Panorámica convencional.
• Aumento de 20: Aplicación de lugol al 2%. Comparable a la de la
colposcopia, permite localización de zona de transformación
yodo-negativa.
• Aumento de 60: Microscópico de contacto, aplicación de azul de
Waterman o de toluidina al 1%, si previamente se ha utilizado ácido
acético. Observación del epitelio pavimentoso en Arquitectura,
topografía, localización, extensión, distribución de estructuras
glandulares y vascularización. Esta fase es la más adecuada para
efectuar rastreo rápido y completo del cuello identificando zonas
sospechozas.
• Aumento de 150: Observa la relación núcleo-citoplasma así como las
características de los mismos, esta fase es la más minuciosa y que nos
permite hacer el diagnóstico y dirigir la biopsia, (fig. 5, 6 y 7).
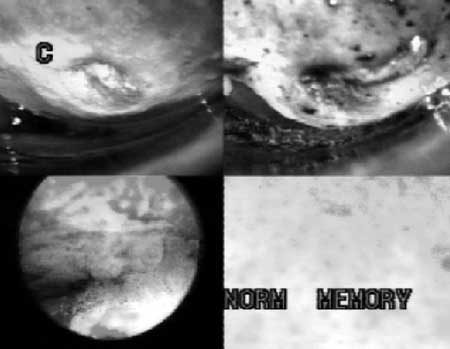 |
(fig. 5 ) Con aumentos de 1, 20 y 60 se observa la limpieza con
solución fisiológica seguido de aplicación de lugol y luego de Azul de
Waterman.
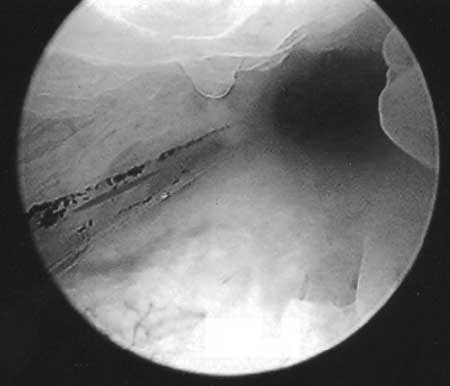 |
(fig. 6) Se inicia la evaluación en el conducto endocervical desde el
orificio interno buscando la zona de transformación, con aumentos de 1,
20 y 60.
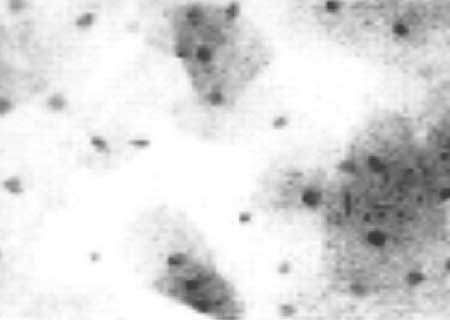 |
(fig. 7) Con aumento de 150 se observa la relación núcleo-citoplasma.
Zona de transformación normal
• Se haya comprendida en la unión entre los bordes del epitelio escamoso maduro y el borde del epitelio cilíndrico.
• Es de un promedio de 2mm de ancho y muy regular, por lo que su
exploración se realiza por rotación de la óptica, quedando totalmente
incluida en el campo visual, siguiendo las agujas del reloj, cubriendo
los cuatro cuadrantes, sin embargo puede ser más ancha e irregular por
los procesos metaplásicos fisiológicos, es necesario en algunas
ocasiones repetir la aplicación de los colorantes vitales por dentro
del inicio del conducto endocervical por las lengüetas de estos
procesos, así como por su menor afinidad a los mismos.
• Está formada por células metaplásicas que en su fase más inmadura se
observan recubriendo las papilas endocervicales, las parabasales,
básales e intermedias carentes de glucógeno, no toman el lugol,
tiñéndose sólo con azul de waterman o toluidina se observa como una
franja azul con 2 bordes:
• Borde interno (escamocolumnar): Formado por unión escamocolumnar es irregular y menos definida por los procesos metaplásicos.
• Borde externo (escamo escamoso): Bordes formados por células maduras
teñidas por lugol más hacia fuera y de menor madurez con coloración
azul hacia adentro, (fig. 8 y 9)
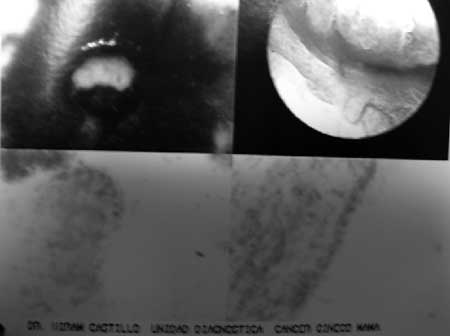 |
(fig. 8) Con aumento de 150 se observa la zona de transformación en sus bordes externo e interno.
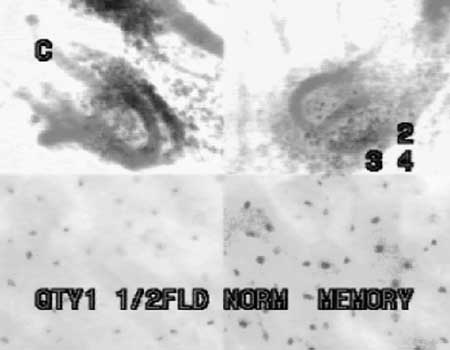 |
(fig. 9) Se observa las células metaplásicas recubriendo las papilas en su proceso de maduración.
Epitelio pavimentoso normal
• Tras la aplicación de los colorantes vitales, se observan células
superficiales con núcleos pequeños, picnóticos, valorando su
disposición horizontal y característica de normalidad, en su relación
núcleo-citoplasmática, permitiéndonos incluso valorar el estado hormonal
en función de su maduración, conforme nos vamos más hacia el exterior o
periferia podemos observar una maduración más avanzada de células con
sus membranas vecinas unas con otras formando los puentes
intercelulares, adquiriendo el lugol oscuro, eventualmente con
procesos de queratinización, donde los núcleos ya no son bien definidos,
incluso no visibles, (fig. 10)
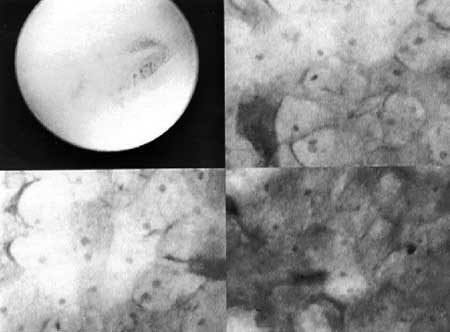 |
(fig.10) Se observa un proceso de maduración avanzada con las células formando los puentes intercelulares.
Epitelio endocervical columnar normal
• El colorante azul de waterman o toluidina, permite la tinción
únicamente del grupo de papilas cilíndricas que se encuentran en
contacto con exocérvix, por tener menor capacidad de secretar moco. Este
epitelio se visualiza mejor con azul de metileno al 1%, (fig. 11 y 12)
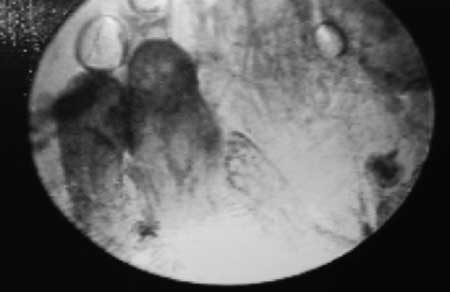 |
(fig. 11). Grupo de papilas cilíndricas cercanas a la zona de transformación.
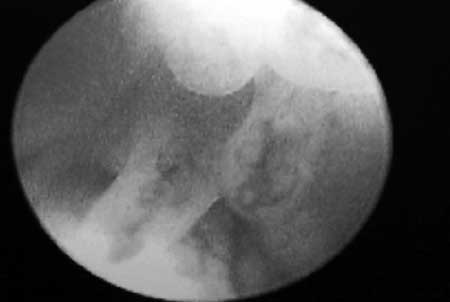 |
(fig.12). Papilas cilíndricas en el canal endocervical.
Ectopia
• Es el epitelio cilíndrico que se encuentra ocupando fuera de su
lugar normal un área mayor o menor del epitelio escamoso normal. Hay
una disminución significativa de la carga de moco, debido a la
exposición del medio ácido vaginal y a los fenómenos metaplásicos
iniciales, aquí la tinción con azul de waterman o toluidina es
suficiente para la observación celular, identificando las estructuras
papilares y vasos capilares terminales, (fig. 13).
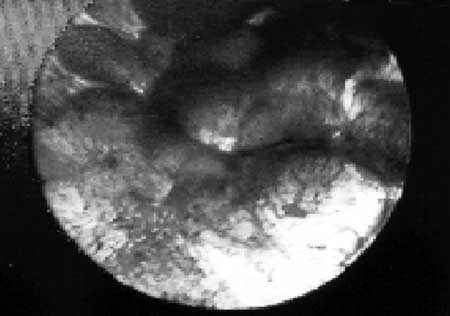 |
(fig. 13) Grupo de papilas cilíndricas dentro del epitelio escamoso.
Zona de transformación anormal
• El MCH, localiza la zona de mayor alteración arquitectural, celular
y vascularización. Se individualizan fácilmente los límites de la
lesión, observa con nitidez el paso del epitelio escamoso normal al
epitelio atípico, se realiza biopsia dirigida a dicho nivel, evitando
tomar muestras equivocadas o poco exactas, detecta los microcondilomas o
alteraciones celulares compatibles con infección vírica.
Aspectos microcolpohisteroscopicos de la zona de transformación atípica:
• Pérdida de la arquitectura normal; desorden y pérdida de orientación.
• Anomalías nucleares; polimorfismos, hipercromasia, hipertrófico.
• Relación núcleo citoplasma alterada; citoplasma toma mal el colorante
disminuido en tamaño, en comparación con un núcleo más grande
• Vascularización atípica; hipervascularización, anomalías en calibre y
trayecto según el grado de lesión, tortuosidades, fragilidad capilar,
(fig. 14).
 |
(fig. 14) Con aumento de 150 se observan las anomalías nucleares de hipercromasia, hipertrofia y polimorfismo.
Cáncer microinvasivo
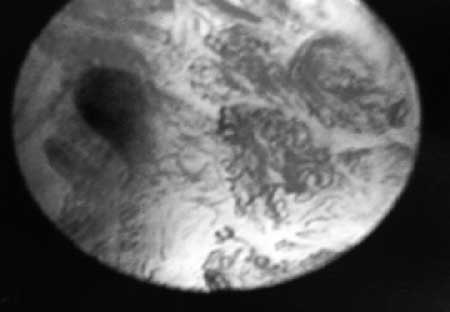 |
(Fig. 15) Se observan los cambios vasculares en su trayecto, grosor y acodaduras.
• Es el patrón vascular fácilmente identificable, a través de la
microcolpohisteroscopia, que nos permite llevar a cabo un diagnóstico
más preciso de invasión precoz, ( fig. 15)
Microcolpohisteroscopia y viariasis
• Queratosis superficial: Áreas que toman débilmente el lugol,
observándose blanco amarillento. Escamas anucleadas que toman
intensamente el azul de toluidina, confiere aspecto sucio al campo.
• Coilocitosis: A nivel de células superficiales del epitelio maduro.
Halo perinuclear, vacuolización y balonización del citoplasma.
• Alteraciones nucleares: Bi o multi nucleaciones, núcleos
hipertróficos, hipercromáticos, claros e irregulares, su comparación
entre si y en especial con el tejido normal facilita el diagnóstico.
• Disposición en espiral: Corresponde a una primera fase de condiloma
papilar en que las células superficiales yodo-negativas se disponen en
forma espiraliforme, formando la base de futuras papilas, ( fig. 16 y
17)
 |
( fig. 16) Vacuolización y balonización del citoplasma, pérdida de la forma poligonal de la célula.
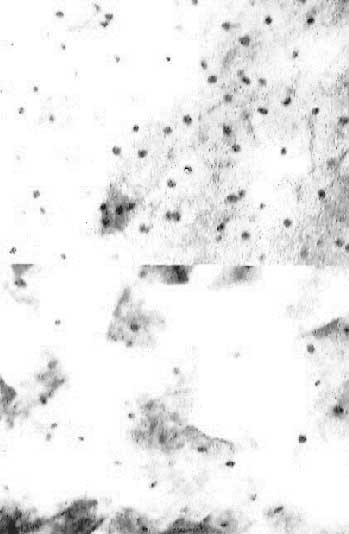 |
(fig. 17) Presencia de binucleaciones, hipercromasia.
Condilomas
• Micropapilares: son pequeñas digitaciones puntiagudas y coniformes
(espículas) de coloración azulada más intensa en el epitelio
circundante, al estar revestidas de células pavimentosas yodo-negativas.
Algunas espículas muestran un halo claro en la base por no tomar esta
tinción. Son móviles, generalmente múltiples y ocasionalmente dejan ver
su eje vascular central, ( fig. 18)
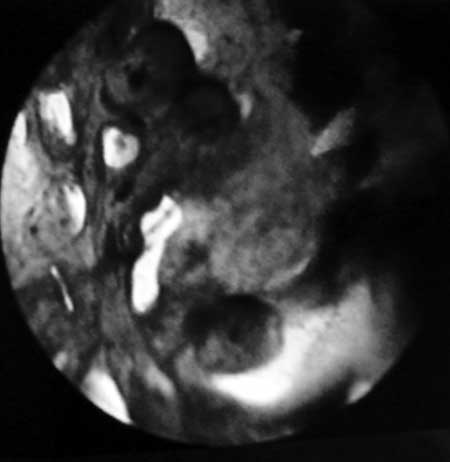 |
( fig. 18 ). Digitaciones coniformes y mayor concentración del Azul de Waterman.
• Papilar: Formado por papilas recubiertas de células escamosas
yodo-negativas, con escasas alteraciones (rara vez asociado a atipia),
centradas por un asa vascular que se caracteriza por su trayecto
tortuoso, ( fig. 19)
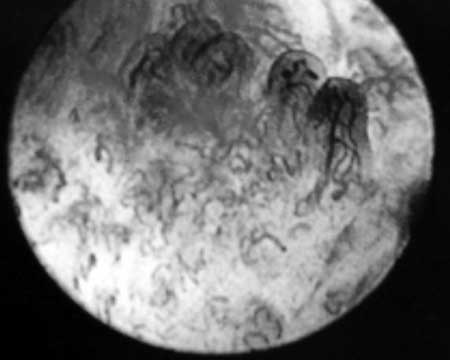 |
( fig. 19) Células escamosas yodo-negativas y asas vasculares con trayecto tortuoso.
Indicaciones de la microcolposcopia
• Colposcopia no satisfactoria ( 15 – 25%).
• Falta de correlación entre citología (positiva ) y colposcopia ( negativa).
• Estenosis cervical
• Sospecha de lesión en canal endocervical
• Determinar el tamaño del cono en extensión y profundidad
La microcolposcopia permite:
• Diagnosticar el tipo de lesión
• Determinar los límites de la lesión
• Establecer el grado de atipía citológica
• Determinar la afectación endocervical
• Dirigir la biopsia al epicentro de la lesión. (fig. 20)
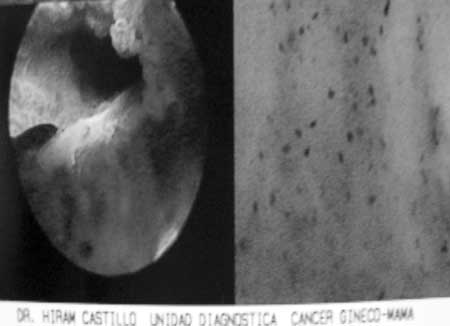 |
(fig. 20) Se determina la afectación endocervical y nos permite dirigir la biopsia al epicentro de la lesión.
Confiabilidad de la microcolposcopía:
92.5%; Dexeus et al, 1990
Sensibilidad: 99%
Especifícidad: 70%
Hunter y Tseng, 1989
Lesión residual post-conización cervical
Con MCH: 0.5%
Sin MCH: 10%
Guerra et al, 1994
REFERENCIA:
SIMPOSIO DE MICROCOLPOHISTEROSCOPIA EN XII WORLD CONGRESS CERVICAL
PATHOLOGY & COLPOSCOPY, en la Ciudad de Cancún, México Junio 05 al
09 del 2005, participantes; Francia Dr. Hamou Jaques, Italia Montevechi
Luigi, Brasil Mioni Sonia, México Ojeda Jorge, Guatemala Castillo Hiram.
BIBLIOGRAFIA
1. Antoine T, Grunberger V. “Die auflichmikroskopie in der gynäkologie” Klin Med 1949; 4: 575.
2. Chappatte OA, Byrne DL, Raju KS, Nayagam M, Kenney A.
“Histological differences between colposcopic-directed biopsy and loop
excision of the transformation zone (LLETZ): a cause for concern”.
Gynecol Oncol 1991; 43: 46-50.
3. De Palo G, Chanen W, Dexeus S. “Patología y tratamiento del tracto genital inferior” 2000, 1: 21-24.
4. Dexeus S, Cararach M, Labastida R, Julvé X, Montesinos M. “Valeur
de la microcolpohystéroscopie lors de l’étude de la pathologie
cervicale” Contraception- Fertilité-Sexualité 1988; 16: 483-487.
5. Dexeus S, Lopez-Marín L, Labastida R, Cararach M, “Tratado y Atlas
de Patología Cervical”, Colposcopia, microcolpohisteroscopia,1989.
6. Dexeus S, Fabregas R, Ara C, Ojeda J, Cararach M, Labastida R.
“The value of microcolpohisteroscopy in the diagnostic assesement of
cervical lesions” The Cervix 1993, 11: 39-43.
7. Dexeus S, Labastida R, Ubeda A. “Microcolpohysteroscopy: Myth or
Reality?” J Lower Genital Tract Disease 1997; 1: 137-140.
8. Fenton DW, Soutter WP, Mann M. “Preliminary experience with
microcolpohysteroscopically controlled cone biopsies” Colposc Gynecol
Laser Surg 1984; 1: 167.
9. Gilbert L, Saunders N, Sharp F. “Microcolpohysteroscopic tailoring
of cervical conization”. Obstet Gynecol 1990; 76: 101-105.
10. Guerra B, Guida G, Falco P, Gabrielli S, Martinelli GN, Bovicelli
L. Microcolpohisteroscopic topographic endocervical asessment before
excesional treatment of cervical intraepithelial neoplasia. Obstet
Gynecol 1996;88:77-81.
11. Guerra B, Zanardi C, De Simone P, Corazza F, Martinelli G,
Bovicelli L. “Discrepanza tra diagnosi istopatologica su biopsia mirata e
su biopsia cónica della cervice uterina: analisi di 346 casi di
láser-conizzazione” Minerva Ginecol 1994; 46: 455-9.
12. Hamou J. “Microhistéroscopie: Une nouvelle technique en endoscopie. Ses aplications” Acta Endoscópica 1980, 10: 415.
13. Hunter V, Tseng P. “Microcolposcopy vs cone histology in
evaluation of the endocérvi in women with inadequate colposcopy or
positive endocervical curettage” J Reprod Med 1989; 34: 625-628.
14. Koss LG. The Papanicolaou test for cervical cancer conization: a triumph and a tragedy. JAMA 1989;261:737.43.
15. Nuovo GJ, Blanco JS, Leipzig S, Smith D. “Human papillomavirus
detection in cervical lesions nondiagnostic for cervical intraepithelial
neoplasia: correlation with Papanicolaou smear, colposcopy, and
ocurrence of cervical intraepithelial neoplasia”. Obstet Gynecol 1990;
75: 1006-11.
16. Pace S, Labi L, Figliolini M, Stentella P, Mastrone M, Villani
C, Lotti G. “Lesioni intraepiteliali cervicali: diagnosi integrata
colpo-microcolposcopica”. Minerva Ginecol 1993; 45: 9-11.
17. Przybora LA, Plutowa A. Histological topography of carcinoma in situ of the cervix uteri. Cancer 1959;127:263.
18. Reed TP, Saade G. “Microcolposcopy. When and How to do it” J Reprod Med 1993; 38: 725-28.
19. Saunders N, Anderson D, Gilbert L. “Endoscopic localization of
the squamocolumnar junction before cervical cone biopsy in 284 patients”
Cancer 1990; 65: 1312-1317.
20. Soutter WP, Fenton DW, Gudgeon P, Sharp F. “Quantitative
microcolpohystéroscopie assessment of the extent of endocervical
involvement by cervical intraepithelial neoplasia”. Br J Obstet
Gynaecol 1984; 91: 712-715.
21. Syrjanen K, Vayrynen M, Saarikoski S, Mantyjarvi R, Parkinen S,
Hippelainen M, Castren O. Natural history of cervical human
papillomavirus (HPV) infections based on prospective follow-up.
22. Toplis PJ, Casemore V, Hallam N, Charnock M. “ Evaluation of
colposcopy in the postmenopausal woman”. Br J Obstet Gynaecol 1986; 93:
843-51.