Nefrotoxicidad por quimioterapia, efectos adversos de la quimioterapia
• Las intervenciones terapéuticas tienen el riesgo de producir toxicidad.
• Estructuras químicas que causan destrucción celular por diversos mecanismos de acción.
• Maximizar los efectos benéficos y disminuir los efectos adversos.
• Efectos citotóxicos tanto en las células normales como en las neoplásicas.
Grever y Grieshaber, 1997.
Nefrotoxicidad
• Riñones: vía de eliminación.
• Toda la unidad anatómica de la nefrona está en riesgo de daño.
• El daño es variado, desde la elevación asintomática de la creatinina hasta el síndrome urémico.
Weiss R B, 1997.

Cisplatino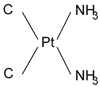 • Cis-Diaminodicloroplatino.
• Cis-Diaminodicloroplatino.
• Complejo inorgánico bivalente hidrosoluble que contiene platino.
• Cáncer testicular, ovárico, cabeza y cuello, vejiga, esófago y pulmón.
• Toxicidad relacionada a la dosis.
• Daño: Túbulos renales.
• Nefrotoxicidad reconocida desde los primeros años de su uso.
• Elevación de la creatinina sérica, alteraciones hidroelectrolíticas, síndrome urémico hemolítico.
Weiss BR, 1997.
Factores de riesgo
• Uso concominante de otros nefrotóxicos.
• Deshidratación
• Dosis mayores de 50 mg/m2
• Edad mayor de 60 años.
• Depuración de creatinina menor a 70 ml/min.
Weiss BR, 1997.
Hipomagnesemia por cisplatino
• Aparentemente dada por el daño tubular.
• Clínicamente evidente en el 10%.
• Puede tener un comportamiento crónico, de meses – años.
• Administración conjunta de Mg.
Lancet 1998; 352: 391-6.
Mecanismo de daño por cisplatino
• Apotosis vs Necrosis: dosis dependiente.
• Formación de puentes de ADN inter e intra cadenas
• Radicales libres de oxígeno: , Peroxidación de lípidos; Citocromo P 450, HO-1.
Kidney Int 1999, 56: 1295-8; Am J Physiol 1996; 270: 700-8.; Am J Physlol 2000; 278: 726-36.
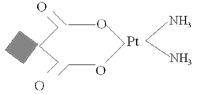 Carboplatino
Carboplatino
• Sintetizado como una alternativa al cisplatino
• Menor nefrotoxicidad.
• No requiere hidratación previa.
• Muy rara vez aumentan los niveles de creatinina sérica.
Weiss BR, 1997.
Prevención de la nefrotoxicidad
• Hidratación con solución salina
• Diuréticos.
• Diuresis: 100 ml/hr.
• Ifosfamida, metimazol, amifostine, probenecid, dietilditiocarbomato, mesna.
Weiss BR, 1997.
Amifostine
• (WR-2721): Tiol natural, que se convierte en los tejidos a una forma activa:
• WR-1065.
• Conversión mediada por una desfosfoliración mediada por fosfatasa alcalina.
• Limpieza de radicales libres de oxígeno
• Donación de hidrógeno para la reparación de moléculas dañadas.
• El amifostine es captado mejor en los tejidos normales que en los neoplásicos.
• Diferencias en el microambiente a nivel de los tejidos.
 J Clin Oncol 1999; 17: 3333-55.
J Clin Oncol 1999; 17: 3333-55.
Fosfatasa alcalina
• Tejidos normales
• Tejido neoplásico
• Reacciones alérgicas.
• Menores concentraciones
• Hipotensión.
• Hipocalcemia.
• Mayores concentraciones en capilares y arteriolas.
• El efecto final es una concentración 100 veces mayor de amifostine en los tejidos normales
• Nausea, vómito, estornudos, rubor o sensación de calor, somnolencia, sabor metálico.
• Reconstituido con 9.5 ml de solución salina al 0.9%
• 500 mg en 10 ml.
• Estable por 6 horas en temperatura ambiente.
• Administración IV por 15 minutos.
• 30 minutos previo a la administración de quimioterapia o radioterapia.
• Vida media plasmática de un minuto.
J Clin Oncol 1999; 17: 3333-55.
Amifostine: Guías de uso para evitar nefrotoxicidad
• El amifostine puede ser usado en pacientes con tratamiento a base de cisplatino para prevenir nefrotoxicidad.
• Nivel de evidencia I
• Grado de recomendación: A.
J Clin Oncol 1999; 17: 3333-55.
Metotrexato
• Cuando se administra a dosis convencionales la nefrotoxicidad es rara.
• Excreción renal.
• En pH < de 5.7 el fármaco se puede precipitar cristalizandose en los túbulos renales.
Kelley WN, 1999.
Mitomicina
• Aislado de Strep. Caespitosus en 1958.
• Contiene un grupo aziridina y un grupo quinona.en su estructura.
• Un anillo mitosano.
• Reacciones de alquilación con el ADN.
• Se convierte en el medio intracelular en un agente alquilante
• Mielosupresión
• Síndrome urémico hemolítico.
• Nausea, vómito, diarrea, estomatitis, dermatitis, fiebre, malestar general.
• El síndrome urémico hemolítico es la manifestación adversa más grave.
• Daño endotelial.
• Dosis totales > 50 mg/m2 pueden desarrollar hemólisis aguda,
anormalidades neurológicas, neumonía intersticial, y daño glomerular.
• Incidencia de hasta un 28% de daño renal en dosis totales de 70 mg/m2 .
Chabner BA, 1997.
Cuadro clínico del daño renal
• Anemia hemolítica grave que precede al daño renal.
• Esquistocitos, trombocitopenia, rash, fiebre, hipertensión arterial, alteraciones neurológicas, pericarditis, neumonitis.
• Hematuria, proteinuria
• Edema pulmonar no cardiogénico.
• Precipitado por transfusiones.
• Mortalidad de un 50%.
Weiss BR, 1997.
Mitomicina
• Se ha demostrado daño endotelial en arterias renales de rata cuando se inyecta directamente.
• Activación plaquetaria, que lleva a la formación de trombos de fibrina en la microcirculación renal.
• Daño mecánico a los eritrocitos.
Am J Patol. 1985; 121: 88-93.
• Tratamiento: hemodíálisis y plasmaféresis.
• Perfusión plasmática sobre filtros que contienen proteína A de estafilococo. (método de extracción de complejos inmunes).
• Sobrevivientes: daño renal crónico.
Weiss BR, 1997.