Dr. Hugo Raúl Castro Salguero. Médico Internista, Oncólogo. HGE – IGSS.
Instituto Nacional de Cancerología INCAN. Grupo Médico Ángeles.
En el Instituto de Cancerología de Guatemala (INCAN) en el año 2005
se atendieron 51,131 consultas, se diagnosticaron 3,877 casos nuevos
cáncer, de estos 2,223 terminaron en cirugías, 47,013 aplicaciones Rt y
1,444 aplicaciones Qt. Esto lleva un promedio de 18 casos nuevos
diarios. En nuestro país como en el resto del mundo se observan las
mismas tendencias a nivel internacional como tercera causa de muerte,
únicamente después de las enfermedades infecciosas (SIDA y tuberculosis)
y de las enfermedades cardiovasculares (diabetes, hipertensión), que
son las llamadas enfermedades catastróficas. Según las estimaciones de
la Organización Mundial de Salud para el 2020, las enfermedades
oncológicas habrán sobrepasado a las enfermedades cardiovasculares.
Por otro lado, se estima que hasta un tercio de las muertes en pacientes
oncológicos, se deben a los diagnósticos tardíos de los médicos que
atienden a los pacientes en las etapas iniciales del cáncer cuando es
más fácilmente tratable. Debido a esto se ha generado un enorme interés
en los marcadores tumorales como ayuda en la detección temprana de la
enfermedad.
Definición: Los marcadores tumorales son sustancias producidas por
las células neoplásicas o inducidas por el huésped ante la presencia de
un tumor maligno. Se utilizan para establecer el pronóstico, realizar
seguimiento o comprobar la eficacia de un tratamiento.
Fue en 1960, cuando se describió la sub-unidad beta de la gonatropina
coriónica humana (ß-GCH), en una paciente que presentó un aborto y tres
meses posterior hemorragia vaginal, con lo que se estableció el
diagnóstico “moderno” de enfermedad de trofoblasto. En 1965 un grupo de
médicos estadounidenses sintetizó el antígeno carcinoembrionario en
pacientes con cáncer de colon. En la década de los ochenta siguió la
síntesis de marcadores basados en glicoproteínas el CA-19.9 para cáncer
de páncreas, el CA-125 para cáncer de ovario, CA-15.3 para cáncer de
mama, alfa-feto-proteina (AFP) para hepatocarcinomas y cáncer de
testículo, finalmente a inicios de la década del noventa se popularizó
el uso del antígeno prostático específico como diagnóstico del cáncer de
próstata (Tabla 1). Ahora el rumbo de la investigación se ha
centralizado en el uso de la inmunohistoquímica y de técnica de
hibridación molecular para la identificación de antígenos tumorales como
los receptores de estrógeno progesterona y Her-2/neu en cáncer de
mama. Este artículo únicamente revisará los marcadores séricos.
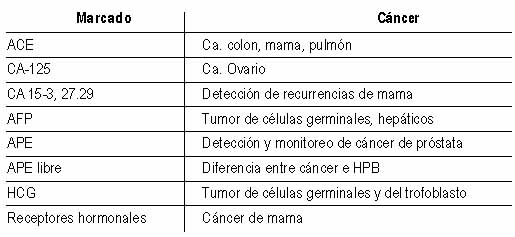
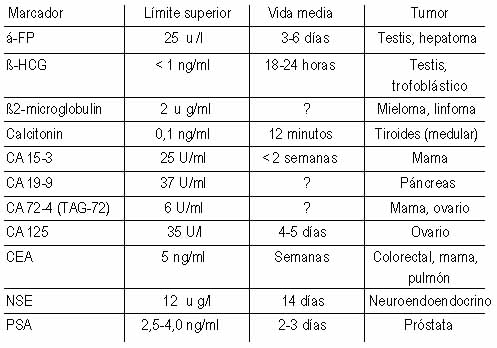
Tabla 1. Marcadores tumorales comúnmente utilizados
¿Cómo probar una prueba? El valor clínico de un marcador dado depende
de su utilidad clínica y de su especificidad y sensibilidad. En esta
línea, el uso de marcadores tumorales no sólo en el diagnóstico y
monitarización de la enfermedad sino a nivel de factores pronóstico o de
riesgo constituye cada vez más un campo de desarrollo. Hay algunas
características que se utilizan para evaluar la utilidad de un marcador
tumoral, la sensibilidad se refiere a la capacidad de una prueba para
detectar pacientes que actualmente presentan la enfermedad. Las
muestras usadas para determinarla proceden de pacientes con cáncer. Por
ejemplo, los pacientes con cáncer de próstata muestran elevación del
APE.
La Especificidad: es la capacidad de una prueba para distinguir
aquellos pacientes que no tienen cáncer de aquellos que lo tienen. Todas
las muestras utilizadas para determinar la especificidad suelen
obtenerse de pacientes sanos y de pacientes con enfermedades no
tumorales. Un valor de especificidad del 100% identificará sólo
pacientes con el tipo concreto de tumor y no otros con lesiones benignas
o enfermedades no tumorales. Es decir el APE, únicamente se encuentra
elevado en pacientes con cáncer de próstata, y no en la hipertrofia
prostática benigna. Hasta ahora no existe el marcador sensible y
específico perfecto. Los que más cerca llegan son la calcitonina en el
raro cáncer medular de tiroides, el APE y la ß-GCH. Los antígenos
oncofetales como AFP, los antígenos mucinosos (CA-15.3, CA-19.9,
CA-125) tienen sensibilidad y especificidad variable. Finalmente las
enzimas como la deshidrogenasa láctica (DHL) tienen baja especificidad,
como lo muestra su elevación en infartos cardiacos.
Las características del marcador tumoral ideal son:
• Ser específico para el tumor (no encontrar el APE elevado en cáncer renal)
• El nivel del marcador debe variar con el tamaño del tumor
• El nivel del marcador tumoral debe elevarse con la presencia de micrometástasis
(no detectarse cuando la enfermedad es evidente macroscopicamente)
• Debe haber diferentes niveles entre pacientes enfermos e individuos sanos
• Barato, reproducible y seguro
ACE
El ACE (antígeno carcinoembrionario) es un complejo
proteína-polisacárido hallado en carcinomas de colon, tracto intestinal,
páncreas, y en el hígado de fetos normales; también podemos encontrar
este marcador con valores positivos en fumadores intensos, en la
cirrosis y en otras enfermedades malignas como cáncer de mama, vejiga,
ovarios y cérvix. El descubrimiento del CEA sólo inició una intensa
búsqueda de lo que se denominó en aquel momento los antígenos tumorales
fetales o las proteínas carcino-embrionarias que derivaban del estudio
de determinadas isoenzimas asociadas a los procesos glicolíticos
El ACE fue descrito por primera vez por Gold y Freedman en 1965, como un
antígeno asociado a los tumores del sistema intestinal. Fue
caracterizado como una glicoproteína con un peso molecular de 200 kDa.
Para 1969, Thompson y col.
desarrollaron un radioinmunoensayo (RIA) para
determinar los bajos niveles de ACE en la sangre de pacientes enfermos.
El RIA permitió detectar niveles elevados de este marcador pero fue una
prueba con poca especificidad, ya que se consideró originalmente que el
ACE era específico de neoplasias del tracto digestivo, pero también se
encuentra aumentado en otros tumores malignos, y en algunas afecciones
no malignas. El descubrimiento del CEA sólo inició una intensa búsqueda
de lo que se denominó en aquel momento los antígenos tumorales fetales o
las proteínas carcino-embrionarias que derivaban del estudio de
determinadas isoenzimas asociadas a los procesos glicolíticos. En la
población sana, la concentración normal es menor a 5 ng/ml en un 99% de
los individuos. La muestra a utilizar puede ser suero o plasma,
conservable en refrigeración o congelación. Los valores de referencia
son de 0-3,4 ng/ml para los no fumadores, o de 0-5,2 ng/ml para los
fumadores.
Las guías de la Asociación Americana de Oncología no recomiendan su
uso para detección temprana, diagnóstico, estadio, ni vigilancia, en
pacientes con cáncer de colon. La medición preoperatoria elevada del
ACE en un paciente diagnosticado de cáncer de colon sirve como
seguimiento para detectar recaída falla al tratamiento. Si la
determinación preoperatoria es normal no está indicado su determinación
subsiguiente.
AFP
La AFP (alfa-fetoproteína) es una glicoproteína de cadena simple de
70 kDa, muy similar a la albúmina, junto con la cual constituyen las
principales proteínas en la circulación del feto. La producción primaria
de AFP ocurre en el hígado fetal y saco vitelino, y se secreta a la
circulación fetal alcanzando un máximo a las 13 semanas, disminuyendo
posteriormente en forma gradual hasta el nacimiento. A la edad de dos
años, apenas se detectan trazas de AFP en el individuo.
La AFP fue descrita en suero fetal por Bergstarnd y Czar en 1956, y
fue asociada con tumores humanos por Tatarinov en 1964. Desde entonces
se ha asociado la elevación de AFP con diversas enfermedades malignas,
principalmente el carcinoma testicular no seminomatoso y el carcinoma
hepatocelular primario. Las estadísticas recientes indican que más del
70% de los pacientes con carcinoma hepatocelular primario tienen
concentraciones elevadas de AFP en suero.
En cuanto a sus indicaciones en oncología, la AFP tiene una
sensibilidad de 30-80% en hepatocarcinomas, dependiendo de su estado.
Diagnóstico: utilizando el criterio de nivel de sospecha y determinación
secuencial. Útil en el 40 a 50% de los casos. Utilidad pronóstica:
niveles arriba de 200ng/mL con sobrevida media de 16 meses contra los
niveles inferiores (34 meses).
En el cáncer testicular no seminomatoso la AFP posee una sensibilidad de
60-80%, y se utiliza en asociación a la subunidad beta de la
gonadotropina coriónica. Sin embargo, la AFP no aumenta en seminomas.
Como prueba postoperatoria, un mes después de cirugía los niveles de
AFP disminuyen considerablemente, lo cual indica buen pronóstico para el
paciente. Sus aumentos indican, al igual que con otros marcadores,
metástasis o recurrencias. La determinación de AFP puede realizarse en
suero, plasma, o líquido amniótico. Los valores de referencia son de
0-15 ng/ml tanto para hombres como para mujeres, en suero. Durante los
procesos de seguimiento, es recomendable utilizar siempre el mismo tipo
de muestra.
La AFP también posee utilidad en la detección precoz de enfermedades
congénitas del tubo neural abierto, tales como anencefalia (falta de
cerebro) y la espina bífida, algunas de las más frecuentes. La AFP se
encuentra elevada en un 99% en el líquido amniótico de los fetos con
defectos abiertos del tubo neural, por lo que su determinación se
utiliza para valorar embarazos de alto riesgo.
Beta-2-microglobulina (B2M): los niveles de B2M se elevan con mieloma
múltiple, leucemia linfocítica crónica (CLL) y algunos linfomas.
También los niveles pueden elevarse con algunas condiciones no
cancerosas, como la insuficiencia renal (enfermedad del riñón). Los
niveles normales por lo general están por debajo de los 2.5 microgramos
por mililitro (ug/mL). Un microgramo es la millonésima parte de un
gramo. La B2M es útil en ayudar a determinar el pronóstico (perspectiva
de sobrevivir a la enfermedad por largo plazo) en algunos de estos
cánceres. Los pacientes con niveles más altos de B2M por lo general
tienen un pronóstico más pobre.
CA 15-3: Se usa principalmente para la observación de pacientes con
cáncer del seno. Los niveles elevados en la sangre se reportan en menos
del 10% de los pacientes con una etapa temprana de la enfermedad,
mientras que se detectan en alrededor de 70% de aquéllos con un estado
avanzado de la misma. Los niveles por lo general bajan enseguida de que
el tratamiento comienza a surtir efecto, aunque pueden subir durante las
primeras semanas tras su inicio, como consecuencia de las células
cancerosas que mueren diseminando su contenido en el torrente sanguíneo.
El nivel normal por lo general es menor a 25 U/mL
(unidades/mililitro), dependiendo del laboratorio. Pero las mujeres que
no tienen cáncer, algunas veces pueden presentar niveles tan altos como
de 100 U/mL. Los niveles de este marcador pueden también ser más
elevados en otros cánceres y en algunas condiciones no cancerosas, como
tumores benignos del seno y hepatitis.
CA 125: Es el marcador tumoral estándar que se usa para observar a
las mujeres durante o después del tratamiento para el cáncer epitelial
de los ovarios (el tipo de cáncer ovárico más común). Los niveles
normales en la sangre normalmente son menores de 30 a 35 U/mL. Más del
90% de los pacientes tienen niveles elevados de CA 125 cuando el cáncer
está avanzado.
Los niveles también son elevados en alrededor de la mitad de las mujeres
cuya enfermedad aún se encuentra confinada al ovario, por lo que se
está estudiando el CA 125 como prueba de detección. El problema con su
uso como prueba de detección es que aún dejaría de detectar muchos
cánceres en estado inicial, y por otro lado, otras condiciones distintas
al cáncer ovárico pueden generar niveles elevados de CA 125. Por
ejemplo, también es elevado en mujeres con fibroides uterinos o
endometriosis (tener células uterinas en lugares anormales), así como
también en hombres y mujeres con cáncer pulmonar y personas que han
padecido de cáncer previamente. Debido a que el cáncer ovárico es una
enfermedad relativamente no frecuente, la prueba es más propensa a
resultar elevada debido a alguna otra causa que el cáncer ovárico.
CA 19-9: Fue originalmente creada para detectar el cáncer
colorrectal, es más sensible al cáncer del páncreas. Por lo general no
detectará fácilmente la enfermedad, por lo que no se usa como una prueba
para la detección. Pero en la actualidad, se considera el mejor
marcador tumoral para observar a los pacientes con cáncer del páncreas.
Los niveles normales de CA 19-9 en la sangre están por debajo de 37
U/mL. Un nivel elevado de CA 19-9 en un paciente con un diagnóstico
reciente implica que tiene la enfermedad en estado avanzado.
El CA 19-9 también puede usarse para el monitoreo o seguimiento del
cáncer colorrectal, pero al ser menos sensible que la prueba CEA, la
mayoría de las organizaciones médicas recomiendan mejor la prueba CEA al
monitorear dicha enfermedad.
El CA 19-9 puede también ser elevado en otras formas del cáncer del
tracto digestivo, especialmente el cáncer de los conductos biliares, y
en algunas condiciones no cancerosas como pancreatitis (inflamación del
páncreas).
Calcitonina: esta es una hormona producida por ciertas células
(células C parafoliculares) en la glándula tiroides, que ayuda a regular
los niveles de calcio en la sangre. En el cáncer de las células C
parafoliculares, llamado carcinoma medular de la tiroides (MTD por sus
siglas en inglés), los niveles de esta hormona están elevados.
Este es uno de los marcadores tumorales poco comunes que pueden
usarse para ayudar a detectar el cáncer en etapa inicial. Debido a que
el MTC por lo general se hereda, se puede medir la calcitonina en la
sangre en los familiares que están en riesgo para detectar el cáncer en
sus etapas más iniciales. Otros tipos de cáncer, particularmente los
tumores cancerosos del pulmón, pueden también generar niveles elevados
de calcitonina, pero la medición de su nivel en la sangre no se utiliza
por lo general como seguimiento de estos tipos de cáncer.
Gonadotropina coriónica humana (â-HCG, por sus siglas en inglés): los
niveles sanguíneos de la HCG (también conocida como beta-HCG) son
elevados en pacientes con ciertos tipos de cáncer testicular y ovárico
(tumores de las células germinales), así como con neoplasia
trofoblástica del embarazo, principalmente el coriocarcinoma. También se
encuentran elevados en algunos hombres con ciertos cánceres en la parte
media del tórax (mediastino), que se originan en las mismas células que
el cáncer de los testículos (neoplasmas de las células germinales
mediastinales). Los niveles de HCG son útiles para diagnosticar estas
condiciones y pueden seguirse durante el tratamiento para monitorear su
efectividad. También es útil en detectar la recurrencia de cáncer una
vez que haya terminado el tratamiento.
La GCH está conformada por 2 sub-unidades Alfa (15, daltons) y Beta
(22,000 daltons). La sub unidad Alfa es idéntica a la sub unidad Alfa de
FSH, LH y TSH. En la facultad de medicina aprendimos que la sub Beta
es específica de la GCH y prácticamente puede ser medida sin reacción
cruzada con otras hormonas. Pero esto no es completamente cierto. Se ha
demostrado un grupo de pacientes quienes por distintos motivos ha
tenido que medirse su actividad B-GCH, encontrándose valores elevados
por un método de laboratorio, siendo llevadas a legrados,
histerectomías aplicación de quimioterapia. El ejemplo más
ilustrativo, se refiere al caso de una paciente de 23 años, que
presentó irregularidad menstrual, se le determinó la ß-GCH, encontrando
un valor de 251 IU/L por método AXSYM. Se practicó un USG pélvico y
laparatomía diagnóstica que fueron normales. Se consideró que la
paciente tenía actividad de la enfermedad y se administró metrotexate y
actinomicina D, por once meses. Los niveles de ß-HCG fueron entre 232 –
300 IU/mL.
Se aplicó un nuevo esquema de quimioterapia, sin respuesta. La
paciente fue llevada a histerectomía abdominal y salpingo oforectomía
bilateral, sin encontrar enfermedad macroscópica.
Se realizó tomografía por emisión de positrones y se demostró una
lesión sospechosa en el pulmón derecho, se efectuó toracoscopía y se
obtuvo una biopsia que no demostró actividad tumoral. En total la ß-HCG
se midió cuarenta y cuatro veces demostrando valores elevados, hasta
que se terminó el reactivo utilizado y se utilizó uno de otra marca,
encontrándose valores normales. El caso anterior llevó a una demanda de
14 millones de dólares.
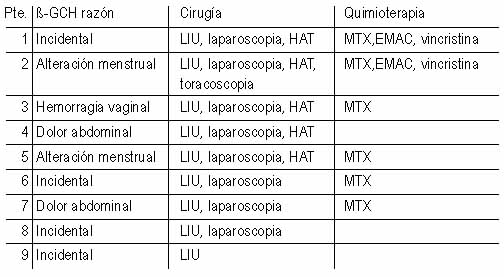
Se han documentado varios casos con el mismo comportamiento que se resumen en la tabla 2.
Tabla 2. Características demográficas de 9 pacientes diagnosticadas de coriocarcinoma por ß-HCG falsamente elevadas
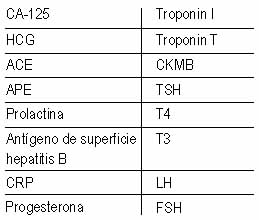
Antes se pensaba que un anticuerpo era específico de un antígeno, sin
embargo hay un grupo de anticuerpos que tienen la facultad de
reaccionar contra múltiples antígenos. Las sustancias que pueden
reaccionar con los diferentes marcadores tumorales se presentan en la
tabla 3.
Tabla 3. Anticuerpos cruzados que reaccionan con anticuerpos heterófilos.
Interpretación de los valores de â-HCG
Cualquier exceso de â-HCG no atribuible a un embarazo actual o recién
finalizado debe interpretarse como debido a actividad tumoral sea
trofoblástica, por un teratoma maligno u otro tipo de cáncer. En opinión
de Bagshawe y cols. (95) la frecuencia de elevaciones de la â-HCG no
debida a tumores trofoblásticos es menor del 10% y las tasas por lo
general inferiores a 100 IU/l.
Los estudios realizados in vitro e in vivo sugieren que una célula
tumoral trofoblástica produce diariamente 10-4-10-5 IU hCG. De ahí que
cuando no se detecta â-HCG en plasma todavía puedan quedar entre 10.000 y
100.000 células viables que justifican “recaídas” tras una aparente
remisión y enfatiza la necesidad de contar con tres determinaciones
negativas separadas por una semana antes de pasar a medir la hormona
mensualmente.
– Los criterios para considerar anormal la curva de â-HCG son:
– Elevación = al 10% respecto a la cifra precedente.
– Estabilización de la curva: descenso menor del 10% de 3 valores separados entre sí por 1 semana.
– Cifra > 20.000 mIU/ml a las 4 semanas postevacuación.
PSA (Antígeno Carcinoembrionario)
El adenocarcinoma de próstata representa un número apreciable de
procesos malignos en varones de más de 50 años y su incidencia aumenta
cada década, con unos 122.000 nuevos casos al año en EUA. Su etiología
es desconocida, pero se han implicado a las hormonas masculinas en el
proceso. Otro tipo de cáncer de la próstata es el sarcoma, pero este
tipo de cáncer es bastante raro y generalmente afecta niños. En cuanto a
la histología del cáncer prostático maligno habitual es glandular y no
difiere de la configuración histológica de la próstata normal. Los
criterios histológicos de diagnóstico son la presencia de grandes
nucleolos en la mitosis, y la invasión tanto del estroma como de los
linfáticos perineurales.
PSA es el mejor método de detección temprana. PSA fracción libre es
de utilidad en discriminar enfermedad benigna de maligna: (a mayor
fracción libre menos posibilidad de cáncer). Puede tener un rol
importante también en insistir en la posibilidad de cáncer aún con
biopsias negativas y tacto rectal positivo en aquellos pacientes entre 4
y 10ng/mL
Conclusiones:
Los marcadores tumorales son sustancias que pueden frecuentemente
detectarse en cantidades superiores a las normales en la sangre, orina, o
en los tejidos de algunos pacientes con ciertos tipos de cáncer. Los
marcadores tumorales pueden ser producidos por el propio tumor o por el
organismo en respuesta a la presencia del cáncer o de algunas
situaciones benignas no cancerosas.
La determinación de los marcadores tumorales puede ser de utilidad en
la detección y diagnóstico de algunos tipos de cáncer, cuando se
combina con otras pruebas diagnósticas.
Sin embargo la determinación de los marcadores tumorales por si sola no es suficiente para diagnosticar el cáncer debido a que:
– los marcadores pueden estar elevados en pacientes con procesos benignos,
– los marcadores tumorales no están elevados en todos los pacientes con cáncer, especialmente en los estadios tempranos,
– muchos de los marcadores tumorales no son específicos de un
determinado tipo de cáncer; los niveles de un marcador tumoral pueden
estar elevados por más de un tipo de cáncer.
Además de su valor en el diagnóstico del cáncer, algunos marcadores
tumorales se miden antes de iniciar el tratamiento como herramienta para
la elección y planificación del tratamiento.
En algunos tipos de cáncer el nivel de los marcadores puede reflejar
la extensión de la enfermedad. La medida de los marcadores durante el
tratamiento puede ser de gran utilidad para poder monitorizar la
respuesta del paciente al mismo: un descenso o retorno a los niveles
normales pueden indicar que el tumor ha respondido favorablemente a la
terapia; si el marcador se eleva puede indicar que el cáncer está
creciendo. Finalmente la determinación de marcadores puede ser utilizada
después del tratamiento como parte del seguimiento, para detectar la
recidiva.
La existencia de una prueba analítica capaz de detectar certeramente
las metástasis sería de gran utilidad en el seguimiento de pacientes
asintomáticos. Como todos los test de cribado, estas pruebas analíticas
serían válidas únicamente si su sensibilidad y especificidad, así como
la incidencia del acontecimiento que predicen fuesen relativamente
altas.
Algunos marcadores de este tipo han sido postulados como adecuados
para este fin en el cáncer de mama; aquí se incluyen moléculas que se
elevan de forma no específica con cualquier proceso inflamatorio (los
llamados reactivos de fase aguda), sustancias que se elevan en el
contexto de anomalías de órganos concretos (por ejemplo: enzimas de
función hepática, enzimas y proteínas óseas), y marcadores tumorales
relativamente específicos como el CEA y el CA15.3.
Bibliografía
1.Yamauchi H, Stearns V, Hayes DF. When is a tumor marker ready for
prime time? A case study of c-erbB-2 as a predictive factor in breast
cancer. J Clin Oncol 2001;19:2334-2356.
2.Ogose A, Hotta T, Kawashima H, Hatano H, Umezu H, Inoue Y, et al.
Elevation of serum alkaline phosphatase in clear cell chondrosarcoma of
bone. Anticancer Res 2001;21:649-655.
3.Taback B, Morton DL, O’Day SJ, Nguyen DH, Nakayama T, Hoon DS. The
clinical utility of multimarker RT-PCR in the detection of occult
metastasis in patients with melanoma. Recent Results Cancer Res 2001;
158:78-92.
4.Gulley ML. Molecular diagnosis of Epstein-Barr virus-related diseases. J Mol Diagn. 2001;3:1-10.
5.Yu H. Clinical implications of prostate-specific antigen in men and women. J Gend Specif Med 2000;3:45-8,53.
6. Sorenson GD. Detection of mutated KRAS2 sequences as tumor markers in
plasma/serum of patients with gastrointestinal cancer. Clin Cancer Res
2000;6:2129-2137.
7.Camera A, Villa MR, Rocco S, De-Novellis T, Costantini S, Pezzullo L,
et al. Increased CA 125 serum levels in patients with advanced acute
leukemia with serosal involvement. Cancer 2000;88:75-78.
8.Brawer MK. Prostate-specific antigen. Semin Surg Oncol 2000;18:3-9.
9. Brown FM. Urine cytology. It is still the gold standard for screening? Urol Clin North Am 2000;27:25-37.
10.Gertz MA, Fonseca R, Rajkumar SV. Waldenstrom’s macroglobulinemia. Oncologist 2000;5:63-67.
11.Black MH, Diamandis EP. The diagnostic and prognostic utility of
prostate-specific antigen for diseases of the breast. Breast Cancer Res
Treat 2000;59:1-14.
12.Gobel U, Schneider DT, Calaminus G, Haas RJ, Schmidt P, Harms D.
Germ-cell tumors in childhood and adolescence. GPOH MAKEI and the MAHO
study groups. Ann Oncol 2000;11:263-271.
13.Heaney AP, Melmed S. New pituitary oncogenes. Endocr Relat Cancer 2000;7:3-15.
14.Hammond ME, Fitzgibbons PL, Compton CC, Grignon DJ, Page DL, Fielding
LP, et al. College of American Pathologists Conference XXXV: solid
tumor prognostic factors-which, how and so what? Summary document and
recommendations for implementation. Cancer Committee and Conference
Participants. Arch Pathol Lab Med 2000; 124:958-965.
15.Shidara Y, Karube A, Watanabe M, Satou E, Uesaka Y, Matsuura T, et
al. A case report: verrucous carcinoma of the endometrium–the difficulty
of diagnosis, and a review of the literature. J Obstet Gynaecol Res
2000;26:189-192.
16.Oberg K. State of the art and future prospects in the management of neuroendocrine tumors. Q J Nucl Med 2000; 44:3-12.
17.Zlotta AR, Schulman CC. Biological response modifiers for the
treatment of superficial bladder tumors. Eur Urol 2000;37(53):10-15.
18. Wells SA, Franz C. Medullary carcinoma of the thyroid gland. World J Surg 2000;24:952-956.
19.ÊSudimack J, Lee RJ. Targeted drug delivery via the folate receptor. Adv Drug Deliv Rev 2000;41:147-162.
20.Raymond E, Soria JC, Izbicka E, Boussin F, Hurley L, Von-Hoff DD. DNA
G-quadruplexes, telomere-specific proteins and telomere-associated
enzymes as potential targets for new anticancer drugs. Invest New Drugs
2000; 18:123-137.
21.ÊYu H, Berkel H. Prostate-specific antigen (PSA) in women. J La State Med Soc 1999;151:209-213.
22.DiBaise JK, Donovan JP. Markedly elevated CA125 in hepatic cirrhosis:
two case illustrations and review of the literature. J Clin
Gastroenterol 1999;28:159-161.
23.ÊWu JT. Review of circulating tumor markers: from enzyme,
carcinoembryonic protein to oncogene and suppressor gene. Ann Clin Lab
Sci 1999;29:106-111.