La diabetes mellitus es la enfermedad metabólica más
frecuente en el mundo y las cifras esperadas de diabéticos para los
siguientes 20 años se estima por arriba de los 300 millones de personas
en todo el mundo, de los cuales alrededor de 250 millones serán
pacientes diabéticos originarios de países en desarrollo (1). El avance
en la ciencia hasta la ingeniería genética y clonación nos permite
disponer de un armamento muy diverso en el tratamiento de los pacientes
diabéticos; por lo que haremos una revisión de los fármacos antiguos así
como de los más recientemente introducidos, iniciando con los fármacos
orales y finalmente con las insulinas.
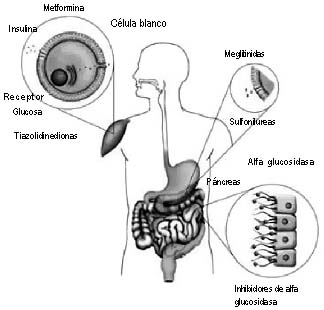 |
Sulfonilureas
Se les conoce desde hace más de 50 años; las de primera
generación introducidas alrededor de 1954 incluyen a la tolbutamida,
cloropropamida, acetohexamida, tolazamida, glicodiazina, tolciclamida,
carbutamida. Las de segunda generación fueron introducidas desde 1967,
son unas 100 veces más potentes que las de primera generación y aunque
son de vida media corta, la duración del efecto hipoglicemiantes dura de
12 a 24 horas lo que permite su uso en monodosis, este grupo incluye
fármacos como la glibenclamida o gliburide, glipizida, gliclazida,
gliquidona, glisoxepida, glibornurida. La última sulfonilurea apareció
en 1995: la glimepirida, que algunos autores la consideran de segunda
generación y otros como el único fármaco de una tercera generación (2).
(vea figura 1)
El mecanismo de acción por el cual las sulfonilureas
producen hipoglicemia se explica a partir de la unión de estos fármacos a
un canal de potasio sensible al ATP para cerrar dicho canal, la
despolarización subsecuente de la membrana plasmática favorece la
apertura de los canales de calcio dependientes de voltaje y el influjode
calcio lo cual estimula la exocitosis de los gránulos secretorios que
contienen insulina pre-formada. En resumen, aumentan la liberaciónde
insulina.
Un punto molecular que no puede pasarse por alto es que los canales
de potasio están distribuidos también en tejidos extrapancreáticos y
están constituidos por dos subunidades: la subunidad que forma el poro o
canal, denominada kir6.2 y la subunidad que constituye el receptor
desulfonilurea, SUR (3). De éste se conoce al momento el gen que
codifica para el SUR1 que es la subunidad reguladora en las células beta
del páncreas y el gen que codifica para SUR2A, una variante que actúa
como receptor en el músculo cardíaco. Esto fue lo que durante algunos
años generó la discusión del uso de sulfonilureas con efectos tanto en
SUR1como en SUR2A por posibles efectos deletéreos cardíacos que no han
sido confirmados en estudios grandes (4).
Otros efectos de las sulfonilureas son la reducción de la depuración
hepática de insulina, aumento del efecto de la insulina en hígado y
tejidos periféricos, aumento de síntesis de glucotransportadores,
reducción de la gluconeogénesis hepática y reducción de secreción
deglucagon, entre otros (5).
Los efectos secundarios, contraindicaciones y dosis de este grupo de
medicamentos como los siguientes se resumen en las tablas
correspondientes.
Meglitinidas
Al igual que las sulfonilureas, las glinidas o
meglitinidas son secretagogos de insulina y comparten el mismo mecanismo
de acción aunque tienen algunas características que las hace muy útiles
en situaciones particulares. Este grupo fue introducido a inicios del
milenio e incluye a 2 fármacos: repaglinida y nateglinida. Tienen un
inicio de acción rápido y vida media corta por lo cual pueden
administrarse al iniciar las comidas y deben dosificarse con cada
alimento por lo cual están indicadas para un adecuado control de
glicemia postprandial. Su metabolismo es hepático y la eliminación
renal es pequeña lo cual permite un uso más seguro en pacientes con
falla renal (5,6).
Inhibidores de alfa glucosidasa
Como su nombre lo indica, este grupo de medicamentos que incluyen la
acarbosa y el miglitol, inhiben de forma competitiva y reversible a las
alfa-glucosidasas intestinales que desdoblen disacáridos a
monosacáridos, disminuyendo la absorción de carbohidratos por el
intestino; no actúa sobre la glucosa intestinal, de ahí que sus efectos
son mayores cuando se administra junto a dietas de alto contenido de
carbohidratos sin glucosa y sacarosa. Permiten un buen control de la
glucosa postprandial y no producen hipoglicemia. Su absorción es mínima
por lo que los efectos secundarios se limitan a los gastrointestinales
(2,5).
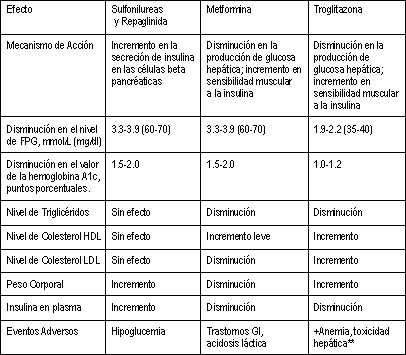 |
| Tabla 1: Comparación de las sulfonilureas y no sulfonilureas cuando se administran como monoterapia |
Biguanidas
La metformina, fenformina y buformina fueron
introducidas entre 1957 y 1958 y de éstas solo se utiliza en la
actualidad la metformina. Si bien el mecanismo de acción no ha sido
establecido con claridad, algunos estudios han dado las luces que
originan sus efectos hepáticos y musculares. Se ha demostrado que la
metformina fosforila y activa una proteina cinasa activada por AMP a
nivel hepático, esto a su vez inactiva la acetil-CoA carboxilasa
incrementando la oxidación de ácidos grasos que se traduce en reducción
en el nivel de triglicéridos y VLDL ((7). La activación de la AMP cinasa
también favorece la inhibición de la producción hepática de glucosa e
induce la captación de glucosa por el músculo esquelético, finalmente
también inhibe la expresión de genes lipogénicos. En el intestino
parecen reducir la absorción de la glucosa.
De su metabolismo podemos mencionar que se absorbe en el intestino
delgado, no se une a proteínas y se excreta sin cambios en la orina. Es
un antihiperglicemiante, no produce hipoglicemias y tiene la ventaja
que no produce aumento de peso, por el contrario se han reportado
reducciones que oscilan alrededor de los 4 kg (2,5).
Glitazonas
Son quizás los primeros fármacos orientados al problema de la
resistencia a la insulina. Las glitazonas o tiazolidinedionas son
ligandos selectivos del receptor activado por proliferador de
peroxisomas gamma, el cual se expresa principalmente en tejido adiposo,
células beta del páncreas, endotelio vascular, macrófagos; en menor
grado se expresan en hígado, corazón y músculo esquelético. Estos PPAR
al igual que las otras 2 subfamilias identificadas al momento (alfa y
beta ) ejercen sus efectos a través de la transactivación y
transrepresión de genes (8). Como resultado las glitazonas producen una
mayor sensibilidad a insulina en tejido adiposo y hepático, disminuyen
la glucosa en ayunas y postprandial así como los ácidos grasos libres y
triglicéridos.
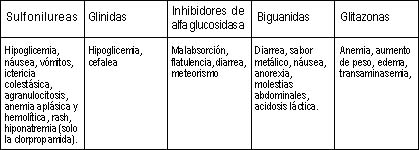
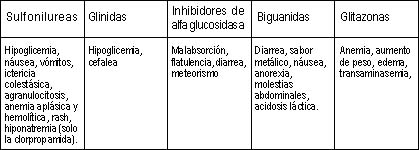 |
| Tabla 2. Reacciones adversas de los hipoglicemiantes orales. |
Los dos medicamentos de este grupo: rosiglitazona y
pioglitazona fueron aprobados para su uso desde 1999, después del retiro
de la troglitazona.
Se absorben relativamente rápido (2 h) pero su efecto máximo se
obtiene después de 6 a 12 h ; se metabolizan en el hígado mediante
enzimas del sistema citocromo P450 y no necesitan ajustarse o
suspenderse en pacientes con insuficiencia renal. Las glitazonas
producen aumento de peso por expansión de grasa subcutánea así como a
retención de líquido y expansión del volumen plasmático.
Un nuevo miembro de esta familia, con efecto dual sobre PPAR alfa y
gamma, es el muraglitazar, que aún no ha sido aprobado para la
comercialización y que su uso está siendo discutido no por los efectos
benéficos sobre glucosa y lípidos sino por los efectos adversos
cardiovasculares: mayor riesgo de ICC, infarto de miocardio, apoplejía o
TIA (9) así como mayor riesgo de cáncer de riñón y vejiga encontrado
en estudios en roedores (10).
 |
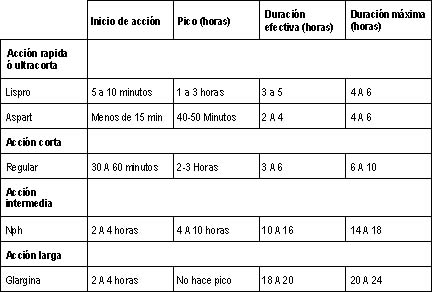 |
| Tabla 4. Comparación de las insulinas subcutáneas. |
Insulinas
La terapéutica con insulinas constituye el tratamiento
básico deldiabético tipo 1 y puede ser usado concomitante a los
hipoglicemiantesorales en los diabéticos tipo 2 cuando aún tienen alguna
reservafuncional de células beta. Un resumen de la farmacocinética
yfarmacodinamia de las insulinas se muestra en la tabla 3.
Acontinuación se harán comentarios particulares a los análogos
deinsulina, que son de más reciente aparición.
Las insulinas humanas son actualmente las de mayor uso y se obtienen
através de ingeniería genética, donde nuevas combinaciones de genes
sonincorporados en bacterias o levaduras para inducir en éstas
laproducción de proinsulina, de la que luego se obtiene insulina
ypeptido C. Los análogos de insulina así obtenidos tienen una
estructurasimilar a la insulina humana con excepción del cambio en
algunosaminoácidos o la adición de ácidos grasos, lo que modifica su
perfilfarmacocinético.
No hay contraindicaciones al tratamientoinsulínico, pueden ser usadas a
cualquier edad, con excepción de lainsulina glargina que está aprobada
para uso en pacientes mayores de 6años. Dentro de los efectos
secundarios se describen la hipoglicemia yla ganancia de peso (11).
En el caso de las insulinasultracortas, la insulina lispro se obtuvo
al invertir los residuos deaminoácidos de las posiciones 28 y 29 de la
cadena beta, prolina-lisinaen la insulina humana a lisina-prolina en la
insulina lispro. Demanera similar la insulina aspart resultó de la
sustitución de prolinapor ácido aspártico en la posición 28 de la cadena
beta. Estos cambiosprevienen la formación de dímeros y hexámeros para
una absorción másrápida (12).
El análogo de acción ultralarga, glargina, resultade la sustitución
de asparagina en la posición 21 de la cadena A porglicina y la adición
de dos residuos de arginina en la posición 30 dela cadena B. Esto se
hace con el objetivo de reducir la solubilidad dela glargina, la cual
precipita al PH del tejido subcutáneo,disminuyendo su absorción y
manteniendo niveles constantes sin picos deliberación de insulina y un
mayor tiempo de duración del efecto.
Así estas tres insulinas tienen un perfil que recuerda la liberación
deinsulina fisiológica tanto basal como estimulada por glucosa.
La insulina lispro y aspart mejoran el control glicémico en tanto
quereducen los aumentos de glucosa postprandial, con menos riesgos
dehipoglicemia. Tienen la desventaja de que necesitan ser
aplicadasvarias veces al día, tienen categoría B y C de riesgo en
mujeresembarazadas (respectivamente) y un costo mayor que las
insulinastradicionales.
Otras insulinas producidas para tener un efectoprolongado y sin pico
posterior a su aplicación han resultado de laacilación de la molécula de
insulina con ácidos grasos; este es el casode la recientemente aprobada
insulina detemir. Una desventaja de éstaes que la duración de su
efecto es dependiente de la dosis, así dosisde 0.1 u/kg, 0.4 u/kg y 1.6
u/kg tienen una duración de 5.7, 19.9 y23.2 horas respectivamente ( 13).
La insulina inhalada (víapulmonar) se absorbe más rápidamente que la
insulina regular subcutáneay retorna a niveles basales más lentamente.
En algunos estudios se hademostrado que cada miligramo de insulina
administrado en un inhaladorde polvo seco equivale más o menos a 3
unidades de insulina subcutánea.Su absorción pulmonar es más rápida, lo
cual permite que se administremás cerca de las comidas, eliminando la
necesidad de inyecciones, conmenos hipoglicemia y menos ganancia de
peso. Tiene la desventaja denecesitar mayores dosis por su limitada
penetración en el alvéolo asícomo un costo alto(11,14).
Análogos de glp-1: Si bien este grupo de fármacos ha
sido el másnovedoso y fue aprobado este año por la Administración de
Drogas yAlimentos de Estados Unidos, han sido estudiados ya desde hace
más deuna década.
Lasincretinas conocidas al momento son el péptido similar a glucagon
–tipo1 (de sus siglas en inglés GLP-1) y el polipéptido
insulinotrópicodependiente de glucosa (GIP) que se producen en las
célulasenteroendócrinas L y K del intestino, respectivamente y tienen
lafunción de favorecer la secreción de insulina después de
laadministración de alimentos. Estas pueden ser degradadas
rápidamentepor la proteasa dipeptidil peptidasa tipo IV, también
conocida comoproteína de superficie de linfocito CD26. Así surgió el
exenatide, unagonista de receptores de GLP-1 resistente a la degradación
y elliraglutide, un segundo análogo pero esta vez acilado a ácidos
grasos,lo que permite su unión a la albúmina y prolonga su vida media (
unasola dosis diaria) (15).
Los efectos que median estos medicamentosincluyen la estimulación de la
secreción de insulina, por lo tanto solopueden ser usados en diabetes
tipo 2; inhiben el vaciamiento gástrico,la secreción de glucagon,
reducen la ingesta de alimentos y la gananciade peso, y quizás uno de
los efectos más específicos de este grupo esque favorece la
proliferación de células beta del páncreas y el aumentode la masa de las
mismas(16). Su administración es vía subcutánea y losefectos
secundarios más severos son náusea en 3 a 5 %, que declinadespués de las
primeras 8 semanas de uso (17); la hipoglicemia esinfrecuente y está
asociada a la dosis del exenatide y a la dosis delos hipoglicemiantes
orales asociados al tratamiento (16 a 35%).
Conclusión:
Una gama de medicamentos tanto orales como subcutáneos y
aún inhaladosestán disponibles para optimizar el control del paciente
diabéticoproporcionando un tratamiento intensivo que no solo permita
laeuglicemia a corto plazo sino también reduzca las
complicacionescrónicas. La combinación de fármacos tanto orales,
subcutáneos yorales-subcutáneos va a estar regida por el conocimiento
médicorespecto a las características de los medicamentos y de cada
pacienteen particular, así como del costo-beneficio y acceso a los
fármacos.
Referencias
1- King H, Aubert RE, Herman WH. Global burden of
diabetes,1995-2015: prevalence, numerical estimates and projections.
DiabetesCare 1998; 21: 1414-1431.
2- Gómez-Pérez F. Avances en Diabetes. 1ª. Edición 1999: 105-152
3- Gribble FM, Tucker SJ, Seino S, et al. Tissue specificity of sulfonylureas. Diabetes 1998; 47:1412-1418.
4- Riddle MC. Sulfonylureas differ in effects on
ischemicpreconditioning- is it time to retire glyburide? J Clin
EndocrinolMetab 2003; 88:528-530.
5- Goodman and Gilman. Bases farmacológicas de la terapéutica. Mc Graw Hill Interanericana. 10a. edición 2003: 1697-1734.
6- Abrahamson M. Optimal glycemic control in type 2 diabetes mellitus. Arch Intern Med 2004; 164:486-491.
7- Zhou G, Myers R, Li Y, et al. Rol of AMP-activated protein kinase
inmechanism of metformin action. J Clin Invest 2001; 108:1167-1174.
8- Yki-Jarvinen H. Thiazolidinediones. N Engl J Med 2004; 351: 1106-1118.
9- Nissen SE, Wolski K, Topol EJ. Effects of muraglitazar on death
andmayor adverse cardiovascular e vents in patient with type w
diabetesmellitus. JAMA 2005; 28:1007-1012.
10- Heavey S. US FDA Questions muraglitazar, novel diabetes drug. Medscape sep 2005.
11- Mayfield JA, White RD. Insulin therapy for type 2 diabetes:
rescue,augmentation and replacement of beta cell function. Am Fam
Physicians2004; 70:489-500.
12- Gerich JE. Novel insulins: expandue options in diabetes management. Am J Med 2002; 113:308-316.
13- Plank J, Bodenlenz M, Sinner F, et al. A double blind,
randomized,dose-response study investigating the pharmacodynamic
andpharmacokinetic properties of the long acting insulin analog
detemir.Diabetes Care 2005; 28:1007-1012.
14- Gómez-Pérez FJ,Hernández-Jimenez S, Aguilar-Salinas CA, et al.
Insulin analogues: acritical review. Rev Invest Clin 2002; 54:527-541.
15- SinclairEM, Drucker DJ. Glucagon-lile peptide 1 receptors agonist
anddipeptidyl peptidasa IV inhibitors: new therapeutic agents for
thetreatment of type 2 diabetes. Curr Opin Endocrinol Diabet
2005;12:146-151.
16- Drucker D. Enhancing incretin actino for the treatment of type 2 diabetes. Diabetes Care 2003; 26:2929-2940.
17- Kendall DM, Riddle MC, Rosentock J, et al. Effects of
exenatide(exendin-4) on glycemic control over 30 weeks in patients with
type 2diabetes treated with metformin and sylfonylurea. Diabetes Care
2005;28:1083-1091.